Cos'è Spiriva?
Confezioni
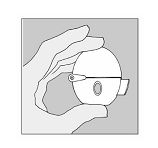
Spiriva 18 microgrammi polvere per inalazione 30 capsule con dispositivo HandiHaler
Informazioni commerciali sulla prescrizione
Se sei un professionista, potrai trovare le schede tecniche complete e molto altro nell'area riservata di Codifa.it
Indicazioni
Perché si usa Spiriva? A cosa serve?
Spiriva è indicato per la terapia broncodilatatoria di mantenimento nel sollievo dei sintomi di pazienti affetti da broncopneumopatia cronica ostruttiva (BPCO).
Posologia
Come usare Spiriva: Posologia
Posologia
Il medicinale deve essere impiegato esclusivamente per uso inalatorio.
Il dosaggio raccomandato di Tiotropio Bromuro è l'inalazione del contenuto di una capsula una volta al giorno, allo stesso orario, effettuata con il dispositivo HandiHaler.
La dose raccomandata non deve essere superata.
Le capsule di Spiriva sono solo per inalazione e non per somministrazione orale. Le capsule di Spiriva non devono essere ingerite.
Le capsule di Spiriva devono essere inalate solo con il dispositivo HandiHaler.
Popolazioni speciali
I pazienti anziani possono utilizzare tiotropio bromuro alla dose raccomandata.
I pazienti con insufficienza renale possono utilizzare tiotropio bromuro alla dose raccomandata. Per pazienti con insufficienza renale da moderata a grave (clearance della creatinina ≤ 50 ml/min) vedere il paragrafo 4.4 e il paragrafo 5.2.
I pazienti con insufficienza epatica possono utilizzare tiotropio bromuro alla dose raccomandata (vedere paragrafo 5.2).
Popolazione pediatrica
BPCO
Non esiste alcuna indicazione per un uso specifico nella popolazione pediatrica (al di sotto dei 18 anni) per l'indicazione descritta al paragrafo 4.1.
Fibrosi cistica
La sicurezza e l'efficacia di Spiriva 18 microgrammi nei bambini e negli adolescenti non sono state stabilite. Non ci sono dati disponibili.
Modo di somministrazione
HandiHaler è un dispositivo per inalazione messo a punto per consentire ai pazienti di inalare il medicinale contenuto nelle capsule di Spiriva.
HandiHaler non deve essere utilizzato per assumere altri medicinali. Si tratta di un dispositivo per singolo paziente destinato a molteplici usi.
Per garantire una corretta somministrazione del medicinale il paziente deve essere istruito sull'utilizzo dell'inalatore da parte del medico o di altro operatore sanitario.
Istruzioni per la manipolazione e l'uso
I pazienti devono seguire i passaggi seguenti per utilizzare HandiHaler.
 |
Si ricordi di seguire attentamente le istruzioni fornite dal suo medico per l'utilizzo di Spiriva. Dopo il primo utilizzo, può utilizzare il dispositivo HandiHaler fino ad un anno per assumere il medicinale.
|
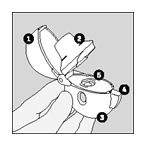 |
Descrizione di HandiHaler
- Cappuccio di chiusura antipolvere
- Boccaglio
- Base
- Pulsante di foratura
- Camera centrale
|
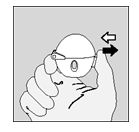 |
- Per sbloccare il cappuccio di chiusura antipolvere premere il pulsante di foratura completamente e poi lasciarlo andare.
|
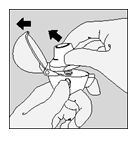 |
- Aprire completamente il cappuccio di chiusura antipolvere sollevandolo verso l'alto. Quindi aprire il boccaglio spingendolo verso l'alto.
|
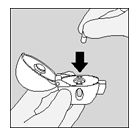 |
- Estrarre una capsula di SPIRIVA dal blister (solo immediatamente prima dell'uso) e inserirla nella camera centrale (5), come illustrato. Non importa in quale modo sia orientata la capsula nella camera.
|
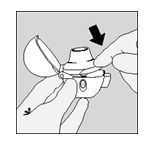 |
- Chiudere bene il boccaglio fino a quando si sente un click, lasciando aperto il cappuccio di chiusura antipolvere.
|
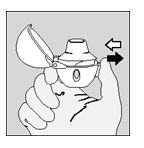 |
- Tenere il dispositivo HandiHaler con il boccaglio rivolto verso l'alto e premere a fondo una volta sola il pulsante di foratura e rilasciare. Questa azione crea fori nella capsula che permette al medicinale di essere rilasciato durante l'inspirazione.
|
 |
- Espirare completamente.
Importante: evitare sempre di respirare nel boccaglio.
|
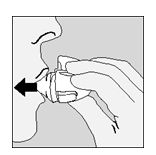 |
- Portare il dispositivo HandiHaler alla bocca e chiudere le labbra fermamente intorno al boccaglio. Tenere la testa in posizione verticale ed inspirare lentamente e profondamente ma ad una velocità sufficiente a udire o sentire vibrare la capsula. Inspirare fino a quando i polmoni non siano pieni; poi trattenere il respiro fino a quando possibile e nello stesso tempo sfilare il dispositivo HandiHaler dalla bocca. Riprendere a respirare normalmente. Ripetere i punti 6 e 7 una volta al fine di svuotare completamente la capsula.
|
|
|
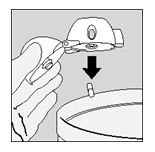
- Aprire ancora il boccaglio. Rovesciare la capsula utilizzata e gettarla. Chiudere il boccaglio e il cappuccio di chiusura antipolvere per conservare il dispositivo HandiHaler.
|
|
Pulizia del dispositivo HandiHaler
|
|
|
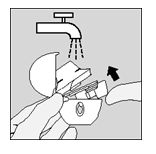
Pulire il dispositivo HandiHaler una volta al mese. Aprire il cappuccio di chiusura antipolvere e il boccaglio. Quindi aprire la base sollevando il pulsante di foratura. Risciacquare tutto l'inalatore con acqua calda per rimuovere la polvere. Asciugare il dispositivo HandiHaler accuratamente rovesciando l'eccesso di acqua su una salvietta di carta e lasciandolo all'aria, mantenendo il cappuccio di chiusura antipolvere, il boccaglio e la base aperti. Poiché occorrono 24 ore per l'asciugatura all'aria, il dispositivo deve essere pulito immediatamente dopo l'utilizzo affinché sia pronto per l'inalazione successiva. Se necessario, la parte esterna del boccaglio può essere pulita con un panno umido ma non bagnato.
|
|
Utilizzo del blister strip
|
|
|
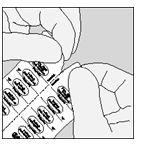
A. Dividere a metà il blister strip tirando lungo la linea perforata
|
|
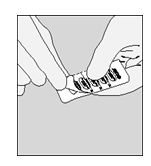
|
B. Sollevare il foglio posto sulla faccia posteriore utilizzando la linguetta fino a che una capsula non sia completamente visibile (solo immediatamente prima dell'uso).
Nel caso una seconda capsula sia inavvertitamente esposta all'aria, deve essere eliminata.
|
|
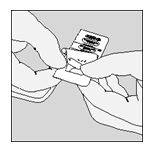
|
C. Estrarre la capsula.
|
Le capsule di Spiriva contengono solo una piccola quantità di polvere, quindi la capsula è riempita solo in parte.
Controindicazioni
Quando non dev'essere usato Spiriva
Ipersensibilità al principio attivo o all'eccipiente elencato al paragrafo 6.1 o all'atropina o ai suoi derivati, ad esempio ipratropio o ossitropio.
Avvertenze speciali e precauzioni di impiego
Cosa serve sapere prima di prendere Spiriva
Tiotropio Bromuro, broncodilatatore di mantenimento, da assumere una volta al giorno, non deve essere utilizzato nel trattamento iniziale di episodi acuti di broncospasmo, quale terapia di emergenza.
Possono verificarsi reazioni di ipersensibilità immediata dopo la somministrazione di tiotropio bromuro polvere per inalazione.
In linea con la sua attività anticolinergica, tiotropio bromuro deve essere utilizzato con cautela nei pazienti con glaucoma ad angolo chiuso, iperplasia prostatica od ostruzione del collo della vescica (vedere paragrafo 4.8).
I medicinali somministrati per via inalatoria possono causare broncospasmo indotto dall'inalazione.
Tiotropio deve essere utilizzato con cautela nei pazienti con infarto miocardico recente, da meno di 6 mesi; nei pazienti che abbiano manifestato una qualsiasi aritmia instabile o pericolosa per la vita o un'aritmia cardiaca che abbia richiesto un intervento o una modifica della terapia farmacologica nell'anno precedente; nei pazienti ospedalizzati per insufficienza cardiaca (Classe NYHA III o IV) nell'anno precedente. Tali pazienti sono stati esclusi dagli studi clinici e queste condizioni possono essere influenzate dal meccanismo di azione anticolinergico.
Poiché la concentrazione plasmatica del medicinale aumenta al diminuire della funzionalità renale, nei pazienti con insufficienza renale da moderata a grave (clearance della creatinina ≤ 50 ml/min), tiotropio bromuro deve essere utilizzato solo se i benefici attesi superano i potenziali rischi. Non ci sono dati a lungo termine in pazienti con insufficienza renale grave (vedere paragrafo 5.2).
I pazienti devono essere avvisati di evitare che la polvere del medicinale venga a contatto con gli occhi. Devono essere informati che ciò può avere come conseguenza una precipitazione o peggioramento del glaucoma ad angolo chiuso, dolore o disturbo oculare, temporaneo offuscamento della vista, aloni visivi o immagini colorate in associazione ad occhi arrossati da congestione congiuntivale ed edema corneale. Se si dovesse sviluppare una qualsiasi combinazione di questi sintomi oculari, i pazienti devono sospendere l'utilizzo di tiotropio bromuro e consultare immediatamente uno specialista.
La secchezza delle fauci che è stata osservata con il trattamento di anticolinergici, a lungo termine può essere associata a carie dentarie.
Tiotropio bromuro non deve essere utilizzato più di una volta al giorno (vedere paragrafo 4.9).
Spiriva capsule contiene 5,5 mg di lattosio monoidrato. Questa quantità normalmente non causa problemi nei pazienti intolleranti al lattosio. I pazienti affetti da rari problemi ereditari di intolleranza al galattosio, da deficit totale di lattasi, o da malassorbimento di glucosio-galattosio, non devono assumere questo medicinale. L'eccipiente lattosio monoidrato può contenere piccole quantità di proteine del latte che possono causare reazioni allergiche.
Interazioni con altri medicinali e altre forme di interazione
Quali farmaci o alimenti possono modificare l'effetto di Spiriva
Benché non siano stati effettuati studi formali di interazione farmacologica, tiotropio bromuro polvere per inalazione è stato utilizzato in concomitanza con altri medicinali senza evidenza clinica di interazioni. Questi comprendono broncodilatatori simpaticomimetici, metilxantine, steroidi orali e per inalazione, comunemente utilizzati nel trattamento della BPCO.
Non è emerso che l'uso di LABA o ICS alteri l'esposizione a tiotropio.
La co-somministrazione di tiotropio bromuro ed altri medicinali contenenti anticolinergici non è stata studiata e pertanto non è raccomandata.
Fertilità, gravidanza e allattamento
Gravidanza
I dati relativi all'uso di tiotropio in donne in gravidanza sono in numero molto limitato. Gli studi sugli animali non indicano effetti dannosi diretti o indiretti con riferimento alla tossicità riproduttiva a dosi clinicamente rilevanti (vedere paragrafo 5.3). A scopo precauzionale, è preferibile evitare l'uso di Spiriva durante la gravidanza.
Allattamento
Non è noto se Tiotropio Bromuro sia escreto nel latte materno. Nonostante studi effettuati su roditori abbiano dimostrato che solo una piccola quantità di tiotropio bromuro è escreta nel latte materno, l'uso di Spiriva non è raccomandato durante l'allattamento. Tiotropio bromuro è una sostanza a lunga durata d'azione. La decisione di continuare o sospendere l'allattamento piuttosto che continuare o sospendere la terapia con Spiriva deve essere presa tenendo in considerazione il beneficio dell'allattamento per il bambino e della terapia con Spiriva per la madre.
Fertilità
Non sono disponibili dati clinici sulla fertilità per tiotropio. Uno studio non clinico condotto con tiotropio non ha messo in evidenza alcun effetto avverso sulla fertilità (vedere paragrafo 5.3).
Effetti sulla capacità di guidare veicoli e sull'uso di macchinari
Non sono stati effettuati studi sulla capacità di guidare veicoli e di usare macchinari. Il verificarsi di vertigini, visione offuscata o cefalea può influire sulla capacità di guidare veicoli e di usare macchinari.
Effetti indesiderati
Quali sono gli effetti collaterali di Spiriva
Riassunto del profilo di sicurezza
Molti degli effetti indesiderati elencati possono essere attribuiti alle proprietà anticolinergiche di Spiriva.
Tabella riassuntiva delle reazioni avverse
La frequenza assegnata agli effetti indesiderati sotto elencati è basata sui tassi grezzi di incidenza delle reazioni avverse al medicinale (cioè eventi attribuiti a tiotropio) osservati nel gruppo trattato con tiotropio (9.647 pazienti), ottenuti raggruppando i dati derivanti da 28 studi clinici controllati verso placebo che prevedevano periodi di trattamento compresi tra quattro settimane e quattro anni.
La frequenza è definita sulla base della seguente convenzione:
Molto comune (≥1/10); comune (≥1/100, <1/10); non comune (≥1/1.000, <1/100); raro (≥1/10.000, <1/1.000), molto raro (<1/10.000), non nota (la frequenza non può essere definita sulla base dei dati disponibili).
|
Classificazione per sistemi e organi secondo MedDRA
|
Frequenza
|
|
Disturbi del metabolismo e della nutrizione
|
|
|
Disidratazione
|
Non nota
|
|
Patologie del sistema nervoso
|
|
|
Vertigini
|
Non comune
|
|
Cefalea
|
Non comune
|
|
Alterazioni del gusto
|
Non comune
|
|
Insonnia
|
Raro
|
|
Patologie dell'occhio
|
|
|
Visione offuscata
|
Non comune
|
|
Glaucoma
|
Raro
|
|
Aumento della pressione intraoculare
|
Raro
|
|
Patologie cardiache
|
|
|
Fibrillazione atriale
|
Non comune
|
|
Tachicardia sopraventricolare
|
Raro
|
|
Tachicardia
|
Raro
|
|
Palpitazioni
|
Raro
|
|
Patologie respiratorie, toraciche e mediastiniche
|
|
|
Faringite
|
Non comune
|
|
Disfonia
|
Non comune
|
|
Tosse
|
Non comune
|
|
Broncospasmo
|
Raro
|
|
Epistassi
|
Raro
|
|
Laringite
|
Raro
|
|
Sinusite
|
Raro
|
|
Patologie gastrointestinali
|
|
|
Secchezza della bocca
|
Comune
|
|
Malattia da reflusso gastroesofageo
|
Non comune
|
|
Stipsi
|
Non comune
|
|
Candidosi orofaringea
|
Non comune
|
|
Ostruzione intestinale, incluso ileo paralitico
|
Raro
|
|
Gengivite
|
Raro
|
|
Glossite
|
Raro
|
|
Disfagia
|
Raro
|
|
Stomatite
|
Raro
|
|
Nausea
|
Raro
|
|
Carie dentaria
|
Non nota
|
|
Patologie della cute e del tessuto sottocutaneo, disturbi del sistema immunitario
|
|
|
Eruzione cutanea
|
Non comune
|
|
Orticaria
|
Raro
|
|
Prurito
|
Raro
|
|
Ipersensibilità (comprese le reazioni immediate)
|
Raro
|
|
Angioedema
|
Raro
|
|
Reazione anafilattica
|
Non nota
|
|
Infezione della pelle, ulcerazione della pelle
|
Non nota
|
|
Pelle secca
|
Non nota
|
|
Patologie del sistema muscoloscheletrico e del tessuto connettivo
|
|
|
Tumefazione articolare
|
Non nota
|
|
Patologie renali e urinarie
|
|
|
Disuria
|
Non comune
|
|
Ritenzione urinaria
|
Non comune
|
|
Infezione del tratto urinario
|
Raro
|
Descrizione delle reazioni avverse selezionate
Negli studi clinici controllati, gli effetti indesiderati comunemente osservati erano quelli anticolinergici, come la secchezza della bocca che si è verificata in circa il 4% dei pazienti.
In 28 studi clinici, la secchezza della bocca ha portato all'interruzione del trattamento da parte di 18 dei 9.647 pazienti trattati con tiotropio (0,2%).
Effetti indesiderati gravi coerenti con gli effetti anticolinergici includono glaucoma, stipsi ed ostruzione intestinale compreso ileo paralitico così come ritenzione urinaria.
Altre popolazioni speciali
Un'aumentata incidenza degli effetti anticolinergici può verificarsi con l'aumentare dell'età.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all'indirizzo
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Sovradosaggio
Cosa fare se avete preso una dose eccessiva di Spiriva
Dosi elevate di Tiotropio Bromuro possono indurre la comparsa di segni e sintomi anticolinergici.
Comunque, nei volontari sani non sono stati osservati effetti avversi sistemici anticolinergici a seguito dell'inalazione di una dose unica fino a 340 microgrammi di tiotropio bromuro. Inoltre, non sono stati osservati effetti avversi rilevanti, oltre alla secchezza delle fauci, a seguito della somministrazione di tiotropio bromuro fino a 170 microgrammi per 7 giorni. In uno studio a dosi multiple condotto in pazienti con BPCO, trattati con una dose massima giornaliera di 43 microgrammi di tiotropio bromuro per 4 settimane, non sono stati osservati effetti indesiderati significativi.
Tiotropio bromuro è caratterizzato da una bassa biodisponibilità orale, pertanto è improbabile che l'ingestione involontaria delle capsule per via orale possa causare un'intossicazione acuta.
Scadenza
2 anni
Utilizzare entro i successivi 9 giorni dalla prima apertura del blister.
Gettare il dispositivo HandiHaler dopo 12 mesi dal primo utilizzo.
Conservazione
Non conservare a temperatura superiore ai 25°C.
Non congelare.
Farmaci Equivalenti
Foglietto Illustrativo
Fonti Ufficiali













