Vistabex
Ultimo aggiornamento: 09/11/2023
Cos'è Vistabex?
Vistabex è un farmaco a base del principio attivo
Tossina Botulinica A, appartenente alla categoria degli
Miorilassanti e nello specifico
Altri miorilassanti ad azione periferica. E' commercializzato in Italia dall'azienda
AbbVie S.r.l..
Vistabex può essere prescritto con Ricetta USPL - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente da specialisti identificati, secondo disposizioni delle Regioni o delle Province autonome.
Vistabex può essere prescritto con Ricetta USPL - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente da specialisti identificati, secondo disposizioni delle Regioni o delle Province autonome.
Confezioni
Vistabex 4 unità allergan/0,1 ml polvere per soluz. iniett. 1 flaconcino 100 unità
Vistabex 4 Unità Allergan/0,1 ml polvere per soluz. iniett. 1 flaconcino 50 Unità
Vistabex 4 Unità Allergan/0,1 ml polvere per soluz. iniett. 1 flaconcino 50 Unità
Informazioni commerciali sulla prescrizione
Titolare: AbbVie S.r.l.
Ricetta: USPL - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente da specialisti identificati, secondo disposizioni delle Regioni o delle Province autonome
Classe: C
Principio attivo: Tossina Botulinica A
Gruppo terapeutico: Miorilassanti
ATC: M03AX01 - Tossina botulinica
Forma farmaceutica: Polvere
Ricetta: USPL - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente da specialisti identificati, secondo disposizioni delle Regioni o delle Province autonome
Classe: C
Principio attivo: Tossina Botulinica A
Gruppo terapeutico: Miorilassanti
ATC: M03AX01 - Tossina botulinica
Forma farmaceutica: Polvere
Se sei un professionista, potrai trovare le schede tecniche complete e molto altro nell'area riservata di Codifa.it
Indicazioni
Perché si usa Vistabex? A cosa serve?
VISTABEX è indicato per il temporaneo miglioramento nell'aspetto di:
- rughe verticali tra le sopracciglia osservate al massimo corrugamento (rughe glabellari) da moderate a gravi e/o,
- rughe cantali laterali (zampe di gallina) da moderate a gravi osservate al massimo sorriso e/o,
- rughe frontali da moderate a gravi osservate alla massima elevazione delle sopracciglia, quando la gravità delle rughe del viso ha un importante impatto psicologico in pazienti adulti.
Posologia
Come usare Vistabex: Posologia
Posologia
Fare riferimento alle raccomandazioni specifiche per ciascuna indicazione di seguito descritta.
Le unità di tossina botulinica non sono intercambiabili da un prodotto all'altro. Le dosi raccomandate in Unità Allergan sono differenti da altri preparati a base di tossina botulinica.
Pazienti anziani
Ci sono limitati dati clinici di studi di fase 3 eseguiti con VISTABEX nei pazienti con età superiore a 65 anni (vedere paragrafo 5.1).
Non è richiesto uno specifico aggiustamento della dose per l'uso negli anziani.
Popolazione pediatrica
La sicurezza e l'efficacia di VISTABEX nel trattamento delle rughe della glabella osservate al massimo corrugamento, delle zampe di gallina osservate al massimo sorriso o delle rughe frontali osservate alla massima elevazione delle sopracciglia non sono state dimostrate negli individui di età inferiore ai 18 anni.
L'uso di VISTABEX non è raccomandato negli individui al di sotto di 18 anni di età (vedere paragrafo 4.4).
Modo di somministrazione
VISTABEX deve essere somministrato soltanto da medici appropriatamente qualificati e con documentata esperienza nel trattamento e muniti delle necessarie attrezzature.
VISTABEX, dopo la ricostituzione, deve essere utilizzato soltanto per il trattamento di un solo paziente durante una singola sessione. L'eccesso di prodotto inutilizzato deve essere smaltito come descritto al paragrafo 6.6. Si devono usare precauzioni particolari durante la preparazione e la somministrazione del prodotto, così come per l'inattivazione e lo smaltimento della rimanente soluzione non utilizzata (vedere i paragrafi 4.4 e 6.6).
Il volume di iniezione raccomandato per ciascuna sede muscolare è 0,1 ml. Fare riferimento anche alla tabella delle diluizioni nel paragrafo 6.6.
Per le istruzioni relative all'impiego, manipolazione e smaltimento dei flaconcini, vedere il paragrafo 6.6.
Si deve prestare attenzione per assicurare che VISTABEX non venga iniettato in un vaso sanguigno quando si effettua l'iniezione nelle rughe verticali tra le sopracciglia osservate al massimo corrugamento (note anche come rughe glabellari), nelle rughe cantali laterali osservate al massimo sorriso (note anche come zampe di gallina) o nelle rughe frontali osservate alla massima elevazione delle sopracciglia, vedere il paragrafo 4.4.
Gli intervalli di trattamento non devono essere inferiori ai tre mesi.
Istruzioni per la somministrazione per le rughe glabellari osservate al massimo corrugamento:
VISTABEX ricostituito (50 Unità/1,25 ml o 100 Unità/2,5 ml) viene iniettato tramite un ago sterile da 30 gauge. Viene somministrato 0,1 ml (4 Unità) di prodotto in ognuna delle 5 sedi di iniezione (vedere Figura 1): 2 iniezioni in ciascun muscolo corrugatore e 1 iniezione nel muscolo procero per una dose totale di 20 Unità.
Prima dell'iniezione, il pollice o l'indice vanno posizionati fermamente sotto il bordo orbitale al fine di prevenire lo stravaso sotto tale bordo. Durante l'iniezione l'ago deve essere orientato verso la parte superiore e mediale.
Al fine di ridurre il rischio di ptosi palpebrale, la dose massima di 4 Unità per ogni sito di iniezione così come il numero dei siti di iniezione non devono essere superati. Inoltre, si deve evitare di effettuare iniezioni vicino al muscolo elevatore della palpebra superiore, in particolare nei pazienti con complessi depressore-sopracciliari più ampi (depressor supercilii). Le iniezioni nel muscolo corrugatore devono essere effettuate nella parte centrale del muscolo, almeno a distanza di 1 cm sopra l'arco sopraccigliare.
Figura 1:
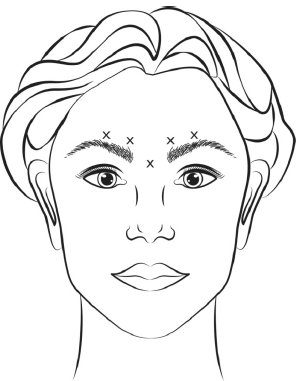
Il miglioramento della gravità delle rughe della glabella osservate al massimo corrugamento si verifica generalmente entro una settimana dal trattamento. L'effetto è stato dimostrato fino a 4 mesi dopo l'iniezione.
Istruzioni per la somministrazione per le zampe di gallina osservate al massimo sorriso:
VISTABEX ricostituito (50 Unità/1,25 ml o 100 Unità/2,5 ml) viene iniettato utilizzando un ago sterile da 30 gauge. Viene somministrato 0,1 ml (4 Unità) di prodotto in ognuno dei 3 siti d'iniezione per lato (per un totale di 6 siti di iniezione) nel muscolo orbicolare laterale dell'occhio, per una dose totale di 24 Unità in un volume totale di 0,6 ml (12 Unità per lato).
Al fine di ridurre il rischio di ptosi palpebrale, la dose massima di 4 Unità per ogni sito di iniezione così come il numero dei siti di iniezione non devono essere superati. Inoltre, le iniezioni devono essere effettuate dal lato temporale del bordo orbitale, mantenendo così una distanza di sicurezza dal muscolo elevatore della palpebra.
Le iniezioni devono essere somministrate con la punta conica dell'ago rivolta verso l'alto e orientata lontano dall'occhio. La prima iniezione (A) deve essere effettuata approssimativamente a 1,5-2,0 cm di distanza dal canto laterale dal lato temporale e appena temporalmente al bordo orbitale. Se le rughe nella zona delle zampe di gallina sono sopra e sotto il canto laterale, iniettare come mostrato nella Figura 2. In alternativa, se le rughe nella zona delle zampe di gallina sono principalmente sotto il canto laterale, iniettare come mostrato nella Figura 3.
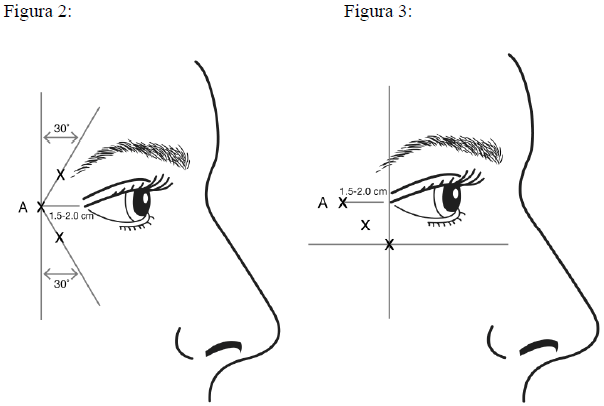
Per il trattamento simultaneo con le rughe glabellari osservate al massimo corrugamento, la dose è di 24 Unità per le zampe di gallina osservate al massimo sorriso e 20 Unità per le rughe glabellari (vedere Istruzioni per la somministrazione per le rughe glabellari e la Figura 1), per una dose totale di 44 Unità in un volume totale di 1,1 ml.
Il miglioramento della gravità delle zampe di gallina osservate al massimo sorriso, quando valutato dallo sperimentatore, si è verificato entro una settimana dal trattamento. L'effetto è stato dimostrato per una mediana di 4 mesi dopo l'iniezione.
Istruzioni per la somministrazione per le rughe frontali osservate alla massima elevazione delle sopracciglia:
VISTABEX ricostituito (50 Unità/1,25 ml o 100 Unità/2,5 ml) viene iniettato utilizzando un ago sterile da 30 gauge. Viene somministrato 0,1 ml (4 Unità) di prodotto in ognuno dei 5 siti d'iniezione nel muscolo frontale, per una dose totale di 20 Unità in un volume totale di 0,5 ml (vedere la Figura 4).
La dose totale per il trattamento delle rughe frontali (20 Unità) unitamente alle rughe glabellari (20 Unità) è di 40 Unità/1,0 ml.
Per identificare la posizione dei siti di iniezione appropriati nel muscolo frontale, deve essere valutata la proporzione complessiva tra la misura della fronte del soggetto e la distribuzione dell'attività del muscolo frontale.
Le seguenti linee orizzontali di trattamento devono essere localizzate mediante leggera palpazione della fronte in posizione di riposo e alla massima elevazione delle sopracciglia:
- Margine superiore dell'attività del muscolo frontale: circa 1 cm sopra la piega più alta sulla fronte
- Riga di trattamento inferiore: a metà tra il margine superiore dell'attività del muscolo frontale e il sopracciglio, almeno 2 cm sopra il sopracciglio
- Riga di trattamento superiore: a metà tra il margine superiore dell'attività del muscolo frontale e la riga di trattamento inferiore
Le 5 iniezioni devono essere effettuate all'intersezione delle righe di trattamento orizzontali con i seguenti punti di riferimento verticali:
- Sulla riga di trattamento inferiore, sulla linea mediana del viso e in posizione mediale di 0,5-1,5 cm rispetto alla linea di fusione temporale (cresta temporale) individuata mediante palpazione; ripetere per l'altro lato.
- Sulla riga di trattamento superiore, a metà tra il sito laterale e mediale della riga di trattamento inferiore; ripetere per l'altro lato.
Figura 4:
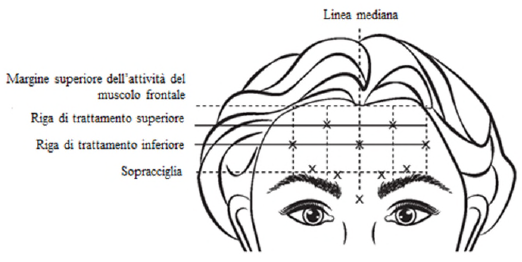
Il miglioramento della gravità delle rughe frontali osservate alla massima elevazione delle sopracciglia si è verificato entro una settimana dal trattamento. L'effetto è stato dimostrato fino a circa 4 mesi dopo l'iniezione.
Per il trattamento simultaneo con le rughe glabellari e le zampe di gallina la dose totale è di 64 Unità, che includono 20 Unità per le rughe frontali, 20 Unità per le rughe glabellari (vedere Istruzioni per la somministrazione per le rughe glabellari e la Figura 1) e 24 Unità per le zampe di gallina (vedere Istruzioni per la somministrazione per le zampe di gallina e le Figure 2 e 3).
Informazioni generali
Nel caso di fallimento dopo il primo ciclo di trattamento, cioè in assenza, dopo un mese dall'iniezione, di un significativo miglioramento rispetto alle condizioni iniziali, si possono considerare i seguenti approcci:
- analisi delle cause dell'insuccesso, ad esempio l'iniezione in muscoli errati, la tecnica di iniezione, la formazione di anticorpi in grado di neutralizzare la tossina, una dose insufficiente;
- rivalutazione dell'appropriatezza del trattamento con tossina botulinica di tipo A.
In assenza di effetti indesiderati secondari al primo ciclo di trattamento, avviare una seconda sessione di trattamento con un intervallo di almeno tre mesi tra le due sessioni di trattamento.
Per le rughe glabellari osservate al massimo corrugamento, in caso di dose insufficiente, iniziare un secondo ciclo di trattamento mediante l'aggiustamento della dose totale fino a 40 o 50 Unità, tenendo in considerazione l'analisi del precedente fallimento della terapia.
L'efficacia e la sicurezza di iniezioni ripetute di VISTABEX oltre 12 mesi non è stata valutata.
Controindicazioni
Quando non dev'essere usato Vistabex
VISTABEX è controindicato:
- negli individui con ipersensibilità nota alla tossina botulinica di tipo A o a uno qualsiasi degli eccipienti della formulazione;
- in presenza di miastenia grave o della Sindrome di Eaton Lambert;
- in presenza di infezione ai siti di iniezione previsti.
Avvertenze speciali e precauzioni di impiego
Cosa serve sapere prima di prendere Vistabex
Si devono usare precauzioni particolari durante la preparazione e la somministrazione del prodotto, così come per l'inattivazione e lo smaltimento della rimanente soluzione non utilizzata (vedere i paragrafi 4.2 e 6.6).
Questo medicinale contiene meno di 1 mmol di sodio (23 mg) per flaconcino, quindi è essenzialmente ‘senza sodio'.
Prima di somministrare VISTABEX, occorre essere a conoscenza dell'anatomia dell'area interessata e di qualsiasi alterazione della situazione anatomica dovuta a precedenti interventi chirurgici e deve essere evitata l'iniezione in strutture anatomiche deboli.
Non devono essere superate le dosi e la frequenza raccomandate per le somministrazioni di VISTABEX.
Molto raramente si può verificare una reazione anafilattica dopo l'iniezione di tossina botulinica. Si deve quindi avere a disposizione l'epinefrina (adrenalina) oppure ogni altra misura antianafilattica.
Pazienti con malattie neuromuscolari non diagnosticate possono essere ad aumentato rischio di effetti sistemici clinicamente significativi tra cui disfagia grave e compromissione respiratoria con dosi normali di tossina botulinica di tipo A. In alcuni di questi casi, la disfagia è durata diversi mesi e ha richiesto il posizionamento di un sondino gastrico per l'alimentazione (vedere paragrafo 4.3).
Deve inoltre essere effettuata particolare attenzione nell'utilizzo di VISTABEX in pazienti affetti da sclerosi amiotrofica laterale o da disordini neuromuscolari periferici.
Sono state segnalate molto raramente reazioni avverse con la tossina botulinica forse correlate alla diffusione della tossina a distanza dal sito di somministrazione (vedere paragrafo 4.8). I pazienti trattati con dosi terapeutiche possono riportare eccessiva debolezza muscolare. Le difficoltà nella deglutizione e nella respirazione sono gravi e possono provocare morte. Non è raccomandata l'iniezione di VISTABEX in pazienti con una storia di disfagia ed aspirazione.
I pazienti o coloro che se ne prendono cura devono essere avvisati di richiedere immediato soccorso nel caso di comparsa di disturbi della deglutizione, della parola o della respirazione.
Un dosaggio eccessivo o troppo frequente può aumentare il rischio di formazione di anticorpi. La formazione di anticorpi può causare l'insuccesso del trattamento con tossina botulinica di tipo A anche per altre indicazioni.
Come per qualunque procedura iniettiva, sono stati associati con l'iniezione dolore localizzato, infiammazione, parestesia, ipoestesia, sensibilità, gonfiore/edema, eritema, infezione localizzata, sanguinamento e/o lividi. Dolore correlato all'ago e/o ansia hanno dato luogo a risposte vasovagali, tra cui una transitoria ipotensione sintomatica e sincope.
Deve essere effettuata attenzione nell'utilizzo di VISTABEX in presenza di infiammazioni nella(e) zona(e) da trattare o in caso di eccessiva debolezza o atrofia del muscolo bersaglio.
Si deve prestare attenzione per assicurare che VISTABEX non venga iniettato in un vaso sanguigno quando si effettua l'iniezione nelle rughe glabellari osservate al massimo corrugamento, nelle rughe laterali cantali osservate al massimo sorriso (note anche come zampe di gallina) o nelle rughe frontali osservate alla massima elevazione delle sopracciglia, vedere il paragrafo 4.2.
A seguito del trattamento vi è il rischio di ptosi palpebrale, pertanto fare riferimento al paragrafo 4.2 per le istruzioni relative alla somministrazione su come ridurre al minimo tale rischio.
L'uso di VISTABEX non è raccomandato negli individui di età inferiore a 18 anni. Ci sono limitati dati clinici di fase 3 sull'uso di VISTABEX in pazienti di età superiore ai 65 anni.
Tracciabilità
Al fine di migliorare la tracciabilità dei medicinali biologici, il nome e il numero di lotto del medicinale somministrato devono essere chiaramente registrati.
Interazioni con altri medicinali e altre forme di interazione
Quali farmaci o alimenti possono modificare l'effetto di Vistabex
Teoricamente, l'effetto della tossina botulinica può essere potenziato da antibiotici aminoglicosidici, spectinomicina, o da altri medicinali che interferiscono con la trasmissione neuromuscolare (es. agenti bloccanti neuromuscolari).
È sconosciuto l'effetto della somministrazione contemporanea o a distanza di alcuni mesi di diversi sierotipi di neurotossine botuliniche. Una eccessiva debolezza neuromuscolare può essere esacerbata dalla somministrazione di una altra tossina botulinica prima della risoluzione degli effetti della tossina botulinica somministrata in precedenza.
Non sono stati eseguiti test specifici per stabilire la possibilità di interazione clinica con altri medicinali. Non sono state segnalate altre interazioni clinicamente significative in tal senso.
Fertilità, gravidanza e allattamento
Gravidanza
Non ci sono dati adeguati sull'uso della tossina botulinica di tipo A nelle donne in gravidanza. Gli studi condotti in animali hanno mostrato tossicità riproduttiva (vedere paragrafo 5.3). Il rischio potenziale per la specie umana non è noto. VISTABEX non è raccomandato durante la gravidanza e in donne potenzialmente fertili che non fanno uso di contraccettivi.
Allattamento
Non ci sono informazioni se VISTABEX sia escreto nel latte umano. L'uso di VISTABEX durante l'allattamento al seno non è raccomandato.
Fertilità
Non ci sono dati adeguati sugli effetti della tossina botulinica di tipo A sulla fertilità di donne potenzialmente fertili. Studi condotti su ratti maschi e femmine hanno mostrato riduzione della fertilità (vedere paragrafo 5.3).
Effetti sulla capacità di guidare veicoli e sull'uso di macchinari
Non sono stati effettuati studi relativi agli effetti sulla capacità di guidare veicoli e di utilizzare macchinari. Tuttavia, VISTABEX può causare astenia, debolezza muscolare, vertigini e disturbi visivi, che possono influenzare la guida e l'utilizzo di macchinari.
Effetti indesiderati
Quali sono gli effetti collaterali di Vistabex
a) Generale
In studi clinici controllati condotti sulle rughe glabellari osservate al massimo corrugamento, gli eventi avversi considerati dai ricercatori correlati all'uso di VISTABEX sono stati riportati nel 23,5% dei pazienti (placebo: 19,2%). Nel ciclo 1 di trattamento degli studi clinici registrativi controllati, condotti sulle zampe di gallina osservate al massimo sorriso, tali eventi sono stati riportati nel 7,6% (24 Unità per le zampe di gallina da sole) e nel 6,2% (44 Unità: 24 Unità per le zampe di gallina somministrate simultaneamente con 20 Unità per le rughe glabellari) dei pazienti rispetto al 4,5% per il placebo.
Nel ciclo 1 di trattamento degli studi clinici per le rughe frontali osservate alla massima elevazione delle sopracciglia, gli eventi avversi considerati dai ricercatori correlati all'uso di VISTABEX sono stati riportati nel 20,6% dei pazienti trattati con 40 Unità (20 Unità sul muscolo frontale con 20 Unità nel complesso glabellare) e nel 14,3% dei pazienti trattati con 64 Unità (20 Unità sul muscolo frontale con 20 Unità nel complesso glabellare e 24 Unità nelle aree delle rughe cantali laterali), rispetto all'8,9% dei pazienti che hanno ricevuto placebo.
Le reazioni avverse possono essere correlate al trattamento, alla tecnica di iniezione o ad entrambi. In generale, le reazioni avverse hanno luogo nei giorni immediatamente successivi all'iniezione e sono transitorie. La maggior parte degli eventi avversi riportati erano di gravità lieve o moderata.
L'azione farmacologica attesa della tossina botulinica è una debolezza muscolare locale. Tuttavia, è stata riportata debolezza muscolare dei muscoli adiacenti e/o lontani dal sito di iniezione.
La blefaroptosi, che può essere correlata alla tecnica di iniezione, è consistente con l'azione farmacologica di VISTABEX. Come per qualunque procedura di iniezione, è possibile rilevare dolore/bruciore/sensazione di puntura, edema e/o lividi in associazione con l'iniezione. Sono state anche riportate febbre e sindrome influenzale a seguito di iniezioni di tossina botulinica.
b) Reazioni avverse - frequenza
Le reazioni avverse sono classificate secondo la Classificazione per Sistemi e Organi e la frequenza è definita come segue: Molto Comune (>1/10); Comune (>1/100, <1/10); Non Comune (>1/1000, <1/100); Rara (>1/10.000, <1/1000); Molto Rara (<1/10.000).
Rughe glabellari
Le seguenti reazioni avverse al farmaco sono state riportate negli studi clinici in doppio cieco controllati con placebo a seguito dell'iniezione di 20 Unità di VISTABEX per le sole rughe glabellari:
|
Classificazione per sistemi e organi
|
Termine preferito
|
Frequenza
|
|
Infezioni e infestazioni
|
Infezione
|
Non Comune
|
|
Disturbi psichiatrici
|
Ansia
|
Non Comune
|
|
Patologie del sistema nervoso
|
Cefalea, parestesia
|
Comune
|
|
Capogiri
|
Non Comune
|
|
|
Patologie dell'occhio
|
Ptosi palpebrale
|
Comune
|
|
Blefarite, dolore oculare, disturbo della vista (incluso visione offuscata)
|
Non Comune
|
|
|
Patologie gastrointestinali
|
Nausea
|
Comune
|
|
Secchezza orale
|
Non Comune
|
|
|
Patologie della cute e del tessuto sottocutaneo
|
Eritema, tensione della pelle
|
Comune
|
|
Edema (facciale, palpebrale, periorbitale), reazione di fotosensibilità, prurito, secchezza della pelle
|
Non Comune
|
|
|
Patologie del sistema muscoloscheletrico e del tessuto connettivo
|
Debolezza muscolare localizzata
|
Comune
|
|
Contrazione muscolare, Segno di Mefisto (sollevamento laterale delle sopracciglia)
|
Non Comune
|
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione
|
Dolore facciale, edema al sito d'iniezione, ecchimosi, dolore al sito d'iniezione, irritazione al sito d'iniezione
|
Comune
|
|
Sindrome influenzale, astenia, febbre
|
Non Comune
|
Zampe di gallina con o senza rughe glabellari
Le seguenti reazioni avverse al farmaco sono state riportate negli studi clinici in doppio cieco controllati con placebo a seguito dell'iniezione di VISTABEX per le zampe di gallina con o senza rughe glabellari:
|
Classificazione per sistemi e organi
|
Termine preferito
|
Frequenza
|
|
Patologie dell'occhio
|
Edema palpebrale
|
Non comune
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione
|
Ematoma al sito di iniezione*
|
Comune
|
|
Emorragia al sito di iniezione*
|
Non comune
|
|
|
Dolore al sito di iniezione*
|
Non comune
|
|
|
Parestesia al sito di iniezione
|
Non comune
|
* reazioni avverse correlate alla procedura
Rughe frontali e rughe glabellari con o senza zampe di gallina
Le seguenti reazioni avverse al farmaco sono state riportate negli studi clinici in doppio cieco controllati con placebo a seguito dell'iniezione di VISTABEX per il trattamento simultaneo delle rughe frontali e delle rughe glabellari con o senza zampe di gallina:
|
Classificazione per sistemi e organi
|
Termine preferito
|
Frequenza
|
|
Patologie del sistema nervoso
|
Cefalea
|
Comune
|
|
Patologie dell'occhio
|
Ptosi palpebrale1
|
Comune
|
|
Patologie della cute e del tessuto sottocutaneo
|
Tensione della pelle
|
Comune
|
|
Ptosi del sopracciglio2
|
Comune
|
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione
|
Lividi al sito di iniezione*
|
Comune
|
|
Ematoma al sito di iniezione*
|
Comune
|
|
|
Dolore al sito di iniezione*
|
Non comune
|
|
|
Patologie del sistema muscoloscheletrico e del tessuto connettivo
|
Segno di Mefisto (sollevamento laterale delle sopracciglia) |
Comune
|
1 Il tempo mediano all'esordio della ptosi palpebrale era di 9 giorni dopo il trattamento
2 Il tempo mediano all'esordio della ptosi del sopracciglio era di 5 giorni dopo il trattamento
* reazioni avverse correlate alla procedura
Non è stata osservata nessuna modifica nel profilo di sicurezza complessivo a seguito di dosi ripetute.c) Dati Post-Commercializzazione (frequenza non nota)
Da quando il farmaco è stato commercializzato per il trattamento delle rughe glabellari, delle zampe di gallina e di altre indicazioni cliniche, sono stati segnalati i seguenti effetti indesiderati o eventi avversi rilevanti da un punto di vista medico:
|
Classificazione per Sistemi e Organi
|
Termine Preferito
|
|
Disturbi del sistema immunitario
|
Anafilassi, angioedema, malattia da siero, orticaria
|
|
Disturbi del metabolismo e della nutrizione
|
Anoressia
|
|
Patologie del sistema nervoso
|
Plessopatia brachiale, disfonia, disartria, paresi facciale, ipoestesia, debolezza muscolare, miastenia grave, neuropatia periferica, parestesia, radiculopatia, sincope, paralisi facciale
|
|
Patologie dell'occhio
|
Glaucoma ad angolo chiuso (per il trattamento del blefarospasmo), ptosi palpebrale, lagoftalmo, strabismo, visione offuscata, disturbi della vista, occhio secco, edema palpebrale
|
|
Patologie dell'orecchio e del labirinto
|
Ipoacusia, tinnito e vertigini
|
|
Patologie respiratorie, toraciche e mediastiniche
|
Polmonite da aspirazione, dispnea, broncospasmo, depressione respiratoria, insufficienza respiratoria
|
|
Patologie gastrointestinali
|
Dolore addominale, diarrea, secchezza delle fauci, disfagia, nausea, vomito
|
|
Patologie della cute e del tessuto sottocutaneo
|
Alopecia, ptosi del sopracciglio, dermatite psoriasiforme, eritema multiforme, iperidrosi, madarosi, prurito, eruzione cutanea
|
|
Patologie del sistema muscolo-scheletrico e del tessuto connettivo
|
Atrofia muscolare, mialgia, contrazioni muscolari localizzate/contrazioni muscolari involontarie
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione
|
Atrofia da denervazione, malessere, piressia
|
Molto raramente sono state segnalate con la tossina botulinica reazioni avverse forse correlate alla diffusione della tossina lontano dal sito di somministrazione (ad esempio debolezza muscolare, disfagia, costipazione o polmonite da aspirazione che può essere fatale) (vedere paragrafo 4.4).
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all'indirizzo https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Sovradosaggio
Cosa fare se avete preso una dose eccessiva di Vistabex
Riferito al VISTABEX, il concetto di sovradosaggio è relativo e dipende dalla dose, dal sito di iniezione e dalle proprietà dei tessuti sottostanti. Non sono stati riferiti casi di tossicità sistemica derivanti dall'iniezione accidentale di tossina botulinica di tipo A. Dosi eccessive possono produrre una generalizzata e profonda paralisi neuromuscolare locale o a distanza. Non sono stati segnalati casi di ingestione di tossina botulinica di tipo A.
I segni di sovradosaggio non sono evidenti immediatamente dopo l'iniezione. In caso di iniezione accidentale o ingestione, il paziente deve essere tenuto sotto controllo medico per alcuni giorni allo scopo di rilevare eventuali segni e sintomi di debolezza generale o paralisi muscolare. Deve essere considerato il ricovero in ospedale per quei pazienti che presentano sintomi di intossicazione da tossina botulinica di tipo A (debolezza generale, ptosi, diplopia, disturbi della deglutizione e della parola, o paresi dei muscoli respiratori).
Scadenza
Tre anni.
Dopo la ricostituzione, si raccomanda l'uso immediato della soluzione; comunque è stata dimostrata la stabilità fisicochimica per 24 ore tra 2°C e 8°C.
Conservazione
Conservare in frigorifero (2-8°C).
Per le condizioni di conservazione del prodotto ricostituito, vedere paragrafo 6.3.
Farmaci Equivalenti
Foglietto Illustrativo
Fonti Ufficiali
© 2022 EDRA S.p.A. - P.iva 08056040960
DPO - dpo@lswr.it