Valganciclovir Sandoz
Ultimo aggiornamento: 30/08/2022
Cos'è Valganciclovir Sandoz?
Valganciclovir Sandoz è un farmaco a base del principio attivo
Valganciclovir Cloridrato, appartenente alla categoria degli
Antiretrovirali e nello specifico
Nucleosidi e nucleotidi, esclusi gli inibitori della transcrittasi inversa. E' commercializzato in Italia dall'azienda
Sandoz S.p.A..
Valganciclovir Sandoz può essere prescritto con Ricetta RR - medicinali soggetti a prescrizione medica.
Valganciclovir Sandoz può essere prescritto con Ricetta RR - medicinali soggetti a prescrizione medica.
Confezioni
Valganciclovir Sandoz 450 mg 60 compresse rivestite con film
Informazioni commerciali sulla prescrizione
Titolare: Sandoz S.p.A.
Ricetta: RR - medicinali soggetti a prescrizione medica
Classe: A
Principio attivo: Valganciclovir Cloridrato
Gruppo terapeutico: Antiretrovirali
ATC: J05AB14 - Valganciclovir
Forma farmaceutica: compresse rivestite
Ricetta: RR - medicinali soggetti a prescrizione medica
Classe: A
Principio attivo: Valganciclovir Cloridrato
Gruppo terapeutico: Antiretrovirali
ATC: J05AB14 - Valganciclovir
Forma farmaceutica: compresse rivestite
Se sei un professionista, potrai trovare le schede tecniche complete e molto altro nell'area riservata di Codifa.it
Indicazioni
Perché si usa Valganciclovir Sandoz? A cosa serve?
Valganciclovir Sandoz è indicato per il trattamento di induzione e mantenimento della retinite da citomegalovirus (CMV) in pazienti adulti con sindrome di immunodeficienza acquisita (AIDS).
Valganciclovir Sandoz è indicato per la prevenzione della malattia da CMV in adulti e bambini (dalla nascita ai 18 anni di età) CMV negativi, sottoposti a trapianto di organo solido da donatore CMV positivo.
Posologia
Come usare Valganciclovir Sandoz: Posologia
Posologia
Attenzione – Al fine di evitare possibili sovradosaggi si raccomanda di attenersi strettamente alle indicazioni sui dosaggi; vedere paragrafi 4.4 e 4.9.
Valganciclovir è metabolizzato a ganciclovir in modo rapido ed esteso dopo somministrazione orale.
La dose orale di valganciclovir 900 mg due volte al giorno è terapeuticamente equivalente a ganciclovir 5 mg/kg due volte al giorno per via endovenosa.
Trattamento della retinite da citomegalovirus (CMV)
Pazienti adulti
Trattamento di induzione della retinite da CMV:
Per pazienti con retinite da CMV in fase attiva, la dose raccomandata è 900 mg di valganciclovir (due compresse di Valganciclovir Sandoz da 450 mg) due volte al giorno per 21 giorni, assunta, quando possibile, con il cibo. Un periodo di induzione più prolungato può aumentare il rischio di tossicità midollare (vedere paragrafo 4.4).
Trattamento di mantenimento della retinite da CMV:
In seguito a trattamento di induzione, o in pazienti con retinite da CMV in fase inattiva, la dose raccomandata è 900 mg di valganciclovir (due compresse da 450 mg di Valganciclovir Sandoz) una volta al giorno, assunta quando possibile con il cibo. I pazienti nei quali la retinite peggiora possono ripetere il trattamento di induzione, tenendo presente la possibilità di resistenza virale al farmaco.
Popolazione pediatrica
La sicurezza e l'efficacia di valganciclovir nel trattamento della retinite da CMV non sono state stabilite da studi clinici adeguati e ben controllati condotti su pazienti pediatrici.
Prevenzione della malattia da CMV nel trapianto di organo solido
Pazienti adulti
Per i pazienti sottoposti a trapianto di rene, la dose raccomandata è di 900 mg (due compresse di Valganciclovir Sandoz da 450 mg) una volta al giorno, iniziando entro i 10 giorni successivi al trapianto e proseguendo fino a 100 giorni dopo il trapianto. Si può continuare la profilassi fino a 200 giorni dopo il trapianto (vedere paragrafi 4.4, 4.8 e 5.1).
Per pazienti sottoposti a trapianto di organo solido escluso il rene, la dose raccomandata è 900 mg (due compresse di Valganciclovir Sandoz da 450 mg) una volta al giorno, iniziando entro i 10 giorni successivi al trapianto e proseguendo fino a 100 giorni dopo il trapianto.
Quando possibile, le compresse devono essere assunte con il cibo.
Popolazione pediatrica
In pazienti pediatrici sottoposti a trapianto di organo solido, a partire dalla nascita e a rischio di sviluppare la malattia da CMV, la dose raccomandata di Valganciclovir Sandoz, in singola somministrazione giornaliera, si basa sulla superficie corporea (BSA) e sulla clearance della creatinina (CrCl) derivata dalla formula di Schwartz (CrCLS) e si calcola usando l'equazione sotto riportata:
Dose pediatrica (mg) = 7 x BSA x CrCLS (vedere formula per la BSA di Mosteller e formula per la clearance della creatinina di Schwartz riportate sotto).
Se la clearance della creatinina calcolata con la formula di Schwartz supera i 150 ml/min/1,73 m2, nell'equazione si dovrà utilizzare un valore massimo di 150 ml/min/1,73 m2:
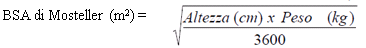
| Clearance della creatinina di Schwartz (ml/min /1,73m2 ) | = | k x Altezza( cm) | |
| ------------------------------------------ | |||
| Creatinina sierica (mg / dl ) | |||
dove k = 0,45* per i pazienti di età < 2 anni; 0,55 per i maschi di età compresa tra i 2 e < 13 anni e le femmine di età compresa tra i 2 e i 16 anni, e 0,7 per i maschi di età compresa tra i 13 e i 16 anni. Per i pazienti di età superiore ai 16 anni, fare riferimento al dosaggio per gli adulti.
I valori di k forniti si basano sul metodo di Jaffe per la misurazione della creatinina sierica e potrebbero richiedere una correzione quando si utilizzano metodi enzimatici.
*Per appropriate sottopopolazioni potrebbe essere richiesta anche una riduzione del valore di k (ad esempio in pazienti pediatrici di basso peso alla nascita).
Per i pazienti pediatrici sottoposti a trapianto di rene, la somministrazione della dose raccomandata in mg per la monosomministrazione giornaliera (7 x BSA x CrCLS) deve iniziare entro i 10 giorni successivi al trapianto e deve proseguire fino a 200 giorni dopo il trapianto.
Per i pazienti pediatrici sottoposti a trapianto di organo solido diverso dal rene, la somministrazione della dose raccomandata in mg per la monosomministrazione giornaliera (7 x BSA x CrCLS) deve iniziare entro i 10 giorni successivi al trapianto e deve proseguire fino a 100 giorni dopo il trapianto.
Tutte le dosi calcolate devono essere arrotondate al più vicino incremento da 25 mg per la dose effettivamente erogabile. Se la dose calcolata supera i 900 mg, si dovrà somministrare una dose massima di 900 mg. La soluzione orale è la formulazione da preferire poichè consente di somministrare una dose calcolata in base alla formula sopra riportata; è tuttavia possibile utilizzare valganciclovir compresse rivestite con film se le dosi calcolate risultano comprese in un intervallo del 10% delle dosi disponibili per le compresse e il paziente è in grado di ingerire le compresse. Ad esempio, se la dose calcolata è compresa tra 405 mg e 495 mg, si potrà assumere una compressa da 450 mg.
Si raccomanda di monitorare regolarmente i livelli di creatinina sierica e valutare le modifiche di altezza e peso corporeo, adattando la dose secondo il caso durante il periodo di trattamento profilattico.
Istruzioni per dosaggi particolari
Pazienti con danno renale:
I livelli di creatinina sierica e di clearance della creatinina devono essere attentamente controllati.
Sono richiesti eventuali aggiustamenti del dosaggio in base ai livelli di clearance della creatinina riportati nella tabella sottostante (vedere paragrafi 4.4 e 5.2).
Una stima della correlazione tra clearance della creatinina (ml/min) e creatinina sierica è data dalla seguente formula:
| Per gli uomini | = |
(140 – età [anni]) x (peso corporeo [kg])
|
|
|
----------------------------------------------------------------------
|
|||
|
(72) x (0,011 x creatinina sierica [micromol/l])
|
|||
Per le donne = 0,85 x valore degli uomini
|
CrCl (ml/min)
|
Dose di induzione di valganciclovir
|
Dose di mantenimento/prevenzione di valganciclovir
|
|
≥60
|
900 mg (2 compresse) due volte al giorno
|
900 mg (2 compresse) una volta al giorno
|
|
40 – 59
|
450 mg (1 compressa) due volte al giorno
|
450 mg (1 compressa) una volta al giorno
|
|
25 – 39
|
450 mg (1 compressa) una volta al giorno
|
450 mg (1 compressa) ogni due giorni
|
|
10 – 24
|
450 mg (1 compressa) ogni due giorni
|
450 mg (1 compressa) due volte alla settimana
|
|
< 10
|
Non raccomandato
|
Non raccomandato
|
Pazienti sottoposti a emodialisi:
Per pazienti in emodialisi (CrCl < 10 ml/min) non può essere raccomandato alcun dosaggio. Valganciclovir Sandoz compresse rivestite con film, non deve essere utilizzato in questi pazienti (vedere paragrafi 4.4 e 5.2).
Pazienti con compromissione epatica:
La sicurezza e l'efficacia di valganciclovir compresse non sono state studiate in pazienti con compromissione epatica (vedere paragrafo 5.2).
Popolazione pediatrica:
Il dosaggio nei pazienti pediatrici sottoposti a trapianto di organo solido deve essere personalizzato sulla base della funzionalità renale, dell'altezza e del peso del paziente.
Pazienti anziani:
La sicurezza e l'efficacia non sono state determinate in questa popolazione di pazienti.
Pazienti con grave leucopenia, neutropenia, anemia, trombocitopenia e pancitopenia:
Vedere paragrafo 4.4 prima di iniziare la terapia.
Se si verificasse una significativa riduzione della conta di cellule ematiche durante la terapia con Valganciclovir Sandoz, è opportuno prendere in considerazione il trattamento con fattori di crescita delle cellule emopoietiche e/o l'interruzione del trattamento (vedere paragrafo 4.4).
Modo di somministrazione
Valganciclovir Sandoz è somministrato per via orale e, quando possibile, deve essere assunto con il cibo (vedere paragrafo 5.2).
Precauzioni da prendere prima della manipolazione o della somministrazione del medicinale:
Le compresse non devono essere rotte o frantumate. Poiché Valganciclovir Sandoz è considerato potenzialmente teratogeno e carcinogeno per l'uomo, deve essere posta attenzione nel maneggiare le compresse rotte (vedere paragrafo 4.4). Evitare il contatto diretto della pelle e delle membrane mucose con le compresse rotte o frantumate. Se si verificasse un contatto del genere, lavare accuratamente con acqua e sapone e sciacquare con cura gli occhi con acqua sterile o con acqua corrente se quella sterile non è disponibile.
Ai pazienti pediatrici che non sono in grado di ingerire è utilizzare un'altra formulazione, ad esempio la polvere per soluzione orale.
Controindicazioni
Quando non dev'essere usato Valganciclovir Sandoz
Valganciclovir Sandoz è controindicato in pazienti con nota ipersensibilità a valganciclovir, ganciclovir o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
Data la stretta somiglianza di struttura chimica tra valganciclovir, aciclovir e valaciclovir, è possibile una reazione di ipersensibilità crociata con questi farmaci. Quindi Valganciclovir Sandoz è controindicato in pazienti con nota ipersensibilità ad aciclovir o valaciclovir.
Valganciclovir Sandoz è controindicato durante l'allattamento al seno (vedere paragrafo 4.6).
Avvertenze speciali e precauzioni di impiego
Cosa serve sapere prima di prendere Valganciclovir Sandoz
Prima di iniziare il trattamento con valganciclovir, i pazienti devono essere informati dei potenziali rischi per il feto. In studi condotti sugli animali il ganciclovir è risultato mutageno, teratogeno, aspermatogeno, carcinogeno e soppressore della fertilità femminile. Valganciclovir Sandoz, pertanto, deve essere considerato potenzialmente teratogeno e carcinogeno per l'uomo con la potenzialità di causare difetti alla nascita e neoplasie (vedere paragrafo 5.3). È molto probabile che Valganciclovir Sandoz causi la temporanea o definitiva inibizione della spermatogenesi. Le donne in età fertile devono adottare misure contraccettive efficaci durante il trattamento. Gli uomini devono utilizzare contraccettivi di barriera durante il trattamento e per almeno 90 giorni dopo la sospensione del farmaco, a meno di non avere l'assoluta certezza che la partner non sia a rischio di gravidanza (vedere paragrafi 4.6, 4.8 e 5.3).
Valganciclovir potrebbe causare carcinogenicità e tossicità a livello riproduttivo a lungo termine.
In pazienti trattati con valganciclovir (e ganciclovir) sono state osservate grave leucopenia, neutropenia, anemia, trombocitopenia, pancitopenia, riduzione della funzionalità del midollo osseo e anemia aplastica. La terapia non deve essere iniziata se la conta assoluta dei neutrofili è inferiore a 500 cellule/ μl o la conta delle piastrine è inferiore a 25000/μl o il livello di emoglobina è inferiore a 8 g/dl (vedere paragrafi 4.2 e 4.8).
Quando la profilassi si estende oltre i 100 giorni, si deve considerare la possibilità che si sviluppi leucopenia e neutropenia (vedere paragrafi 4.2, 4.8 e 5.1).
Valganciclovir Sandoz deve essere usato con cautela nei pazienti con emocitopenia preesistente o con storia pregressa di emocitopenia farmaco-correlata e in pazienti sottoposti a radioterapia.
Durante la terapia si raccomanda di effettuare un monitoraggio periodico della conta completa delle cellule ematiche e delle piastrine. Nei pazienti con danno renale e in quelli pediatrici deve essere effettuato un più frequente monitoraggio della conta delle cellule ematiche, quantomeno ogni volta che il paziente si reca presso il centro trapianti. In pazienti con grave leucopenia, neutropenia, anemia e/o trombocitopenia deve considerarsi l'impiego di fattori di crescita emopoietici e/o l'interruzione della terapia (vedere paragrafi 4.2).
La biodisponibilità di ganciclovir dopo la somministrazione di una dose singola di 900 mg di valganciclovir è pari a circa il 60 %, paragonata ad un 6 % circa di biodisponibilità dopo la somministrazione orale di 1000 mg di ganciclovir (come capsule). Un'esposizione eccessiva a ganciclovir può essere associata ad eventi avversi potenzialmente letali. Di conseguenza si raccomanda la stretta aderenza allo schema di dosaggio all'inizio della terapia, al passaggio dal regime di induzione al regime di mantenimento, e nei pazienti che passano dalla terapia con ganciclovir orale a valganciclovir poichè Valganciclovir Sandoz non può sostituire le capsule di ganciclovir su una base uno a uno. I pazienti che cambiano terapia da ganciclovir capsule devono essere avvertiti del rischio di sovradosaggio in caso di assunzione di un numero di compresse di Valganciclovir Sandoz maggiore di quello prescritto (vedere paragrafi 4.2 e 4.9).
In pazienti con danno renale, sono necessari aggiustamenti della dose sulla base della clearance della creatinina (vedere paragrafi 4.2 e 5.2).
In pazienti in emodialisi Valganciclovir Sandoz compresse rivestite con film, non deve essere usato (vedere paragrafi 4.2 e 5.2).
In pazienti in terapia con imipenem-cilastatina e ganciclovir sono stati riportati casi di convulsioni. Valganciclovir non deve essere usato insieme a imipenem-cilastatina a meno che il potenziale beneficio non superi i potenziali rischi (vedere paragrafo 4.5).
I pazienti trattati con valganciclovir e (a) didanosina, (b) altri farmaci mielosoppressivi (ad esempio zidovudina), o (c) sostanze che alterano la corretta funzionalità renale devono essere attentamente monitorati per segnali di ulteriore di tossicità (vedere paragrafo 4.5).
Lo studio clinico controllato che ha utilizzato valganciclovir per la profilassi della malattia da CMV nel trapianto, come riportato in dettaglio al paragrafo 5.1, non ha incluso pazienti sottoposti a trapianto di polmone o di intestino. Quindi l'esperienza in questo tipo di pazienti è limitata.
Interazioni con altri medicinali e altre forme di interazione
Quali farmaci o alimenti possono modificare l'effetto di Valganciclovir Sandoz
Interazioni di farmaci con valganciclovir
Studi di interazione in vivo non sono stati effettuati con Valganciclovir Sandoz. Poiché valganciclovir è metabolizzato in modo rapido ed esteso a ganciclovir, sono attese le stesse interazioni farmacologiche osservate con ganciclovir.
Interazioni di farmaci con ganciclovir
Imipenem-cilastatina
Sono state riportate convulsioni in pazienti che assumevano contemporaneamente ganciclovir e imipenem-cilastatina. Questi farmaci non devono essere utilizzati contemporaneamente a meno che i potenziali benefici non superino i potenziali rischi (vedere paragrafo 4.4).
Probenecid
Probenecid somministrato insieme a ganciclovir in forma orale determina una riduzione (20%) statisticamente significativa della clearance renale di ganciclovir con conseguente aumento (40%) statisticamente significativo della concentrazione plasmatica. Questi cambiamenti sono legati ad un meccanismo di interazione che determina una competizione per la secrezione tubulare renale. Pertanto pazienti che assumono contemporaneamente probenecid e Valganciclovir Sandoz devono essere strettamente monitorati per la tossicità da ganciclovir.
Trimetoprim
Non si sono osservate interazioni farmacocinetiche clinicamente significative quando trimetoprim e ganciclovir orale sono stati somministrati in associazione. Tuttavia è possibile un potenziamento della tossicità poichè entrambi i farmaci sono noti per essere mielosoppressivi, e quindi entrambi i farmaci possono essere somministrati contemporaneamente solo se i potenziali benefici superano i rischi.
Micofenolato mofetile
Dal momento che sia il micofenolato mofetile (MMF) che il ganciclovir possono indurre neutropenia e leucopenia, è necessario un monitoraggio dei pazienti per controllare la tossicità additiva.
Stavudina
Non sono state osservate significative interazioni tra stavudina e ganciclovir orale quando somministrati contemporaneamente.
Zidovudina
Quando zidovudina è stata somministrata in presenza di ganciclovir orale si è osservato un lieve (17%) ma statisticamente significativo incremento dell'AUC della zidovudina. Quando somministrato con zidovudina, si osservavano inoltre concentrazioni di ganciclovir tendenzialmente inferiori anche se non in modo statisticamente significativo. Tuttavia, poichè sia ganciclovir che zidovudina hanno la potenzialità di causare anemia e neutropenia, alcuni pazienti potrebbero non tollerare la somministrazione concomitante di entrambi i farmaci a dosaggio pieno (vedere paragrafo 4.4).
Didanosina
Le concentrazioni plasmatiche di didanosina sono risultate costantemente aumentate quando questo farmaco è stato somministrato contemporaneamente a ganciclovir (sia per via orale che endovenosa). Un aumento dell'AUC di didanosina compreso tra l'84 e il 124 % è stato osservato con somministrazioni orali di ganciclovir di 3 e 6 g/die; e analogamente è stato osservato un aumento dell'AUC di didanosina tra il 38 e il 67 % con dosi di 5 e 10 mg/kg/die di ganciclovir somministrato per via endovenosa. Non è stato osservato un effetto clinicamente significativo sulle concentrazioni di ganciclovir. I pazienti devono essere strettamente controllati per l'eventuale comparsa di tossicità da didanosina (vedere paragrafo 4.4).
Altri antiretrovirali (inclusa la terapia per HIV, HBV/HCV)
A concentrazioni plasmatiche clinicamente rilevanti di ganciclovir e altri antivirali per l'inibizione del virus dell'immunodeficienza umana (HIV) o HBV/HCV, è improbabile che vi sia un effetto sinergico o antagonistico sull'attività di ganciclovir o degli altri antivirali.
Il potenziale di interazione metabolica di valganciclovir o ganciclovir è basso, a causa del mancato coinvolgimento del citocromo P450 nel metabolismo sia del valganciclovir che del ganciclovir. Inoltre, ganciclovir non è un substrato della glicoproteina -P, né ha effetti sull'enzima UDP-glucuronosiltransferasi (enzima UGT). Pertanto le interazioni metaboliche e dei trasportatori del farmaco di valganciclovir o di ganciclovir con le seguenti classi di farmaci antivirali sono considerate improbabili:
- inibitori della trascrittasi inversa non nucleosidici (NNRTI), ad esempio rilpivirina, etravirina, efavirenz
- inibitori della proteasi (IP), ad esempio darunavir, boceprevir e telaprevir
- inibitori Entry (inibitore della fusione e del co-recettore antagonista CCR5), ad esempio enfuvirtide e maraviroc
- inibitori dell'integrasi dell'HIV (INSTI) ad esempio raltegravir.
Dal momento che ganciclovir è escreto per via renale mediante filtrazione glomerulare e secrezione tubulare attiva (paragrafo 5.2) la co-somministrazione di valganciclovir con farmaci antivirali che condividono il percorso di secrezione tubulare può modificare le concentrazioni plasmatiche di valganciclovir e/o del farmaco co-somministrato. Alcuni esempi includono inibitori nucleosidici analoghi della trascrittasi inversa (NRTI) (compresi quelli utilizzati per la terapia HBV), ad esempio lamivudina, emtricitabina, tenofovir, adefovir ed entecavir. La clearance renale di ganciclovir può essere inoltre inibita a causa della nefrotossicità causata da farmaci quali cidofovir, foscarnet, NRTI (ad esempio tenofovir, adefovir). L'uso concomitante di valganciclovir con uno qualsiasi di questi farmaci deve essere preso in considerazione solo se i potenziali benefici superano i potenziali rischi (vedere paragrafo 4.4).
Altre potenziali interazioni farmacologiche
La tossicità può essere aumentata quando valganciclovir è somministrato contemporaneamente, o assunto immediatamente prima o dopo, ad altri farmaci che inibiscono la replicazione di popolazioni cellulari in rapida divisione come avviene nel midollo osseo, nei testicoli e negli strati germinali della pelle e della mucosa gastrointestinale. Esempi di tali farmaci sono dapsone, pentamidina, flucitosina, vincristina, vinblastina, adriamicina, anfotericina B, trimetoprim/sulfamidici in combinazione, analoghi nucleosidici, idrossiurea e interferoni peghilati/ribavirina (con o senza boceprevir o telaprevir).
L'uso concomitante di tutti questi farmaci con valganciclovir deve essere considerato solo nel caso in cui i potenziali benefici superino i potenziali rischi (vedere paragrafo 4.4).
Fertilità, gravidanza e allattamento
Gravidanza
Non ci sono dati sull'uso di Valganciclovir Sandoz in gravidanza. Il metabolita attivo ganciclovir diffonde rapidamente attraverso la placenta umana. Sulla base del meccanismo d'azione farmacologica e della tossicità riproduttiva osservata negli studi con ganciclovir sugli animali (vedere paragrafo 5.3) vi è il rischio teorico di teratogenicità nell'uomo. L'uso di Valganciclovir Sandoz in gravidanza deve essere evitato a meno che i benefici terapeutici per la madre superino i potenziali rischi di danno teratogeno per il feto.
Allattamento
Non è noto se ganciclovir sia escreto nel latte materno, ma non è possibile escludere la possibilità che ganciclovir venga escreto nel latte materno e causi gravi reazioni avverse nel bambino allattato. Perciò l'allattamento al seno deve essere interrotto.
Fertilità
Le donne in età fertile devono utilizzare durante il trattamento con ganciclovir metodi contraccettivi efficaci. Gli uomini devono essere informati sulla necessità di impiegare contraccettivi di barriera durante e per almeno 90 giorni successivi al trattamento con Valganciclovir Sandoz, a meno che siano sicuri che la partner non sia a rischio di gravidanza (vedere paragrafo 5.3).
Effetti sulla capacità di guidare veicoli e sull'uso di macchinari
Non sono stati effettuati studi sulla capacità di guidare veicoli e sull'uso di macchinari.
Con l'impiego di valganciclovir e/o ganciclovir sono state riportate convulsioni, sedazione, capogiro, atassia e/o confusione. Se si verificano, tali sintomi possono influire sulle attività che richiedono vigilanza quali la guida e l'utilizzo di macchinari.
Effetti indesiderati
Quali sono gli effetti collaterali di Valganciclovir Sandoz
a) Riassunto del profilo di sicurezza
Valganciclovir è un profarmaco di ganciclovir che viene metabolizzato in modo rapido ed esteso a ganciclovir dopo somministrazione orale. Gli effetti indesiderati noti associati all'uso di ganciclovir possono essere attesi anche con valganciclovir. Tutti gli effetti indesiderati osservati nel corso degli studi con valganciclovir sono stati precedentemente osservati con ganciclovir. Le reazioni avverse al farmaco segnalate con maggiore frequenza dopo somministrazione di valganciclovir negli adulti, sono la neutropenia, l'anemia e la diarrea.
Valganciclovir è associato ad un rischio di diarrea superiore al ganciclovir endovena. Inoltre valganciclovir comporta un maggior rischio di neutropenia e leucopenia rispetto a ganciclovir orale.
Una grave neutropenia (ANC < 500 cellule/μl) è stata riscontrata più frequentemente in pazienti con AIDS e retinite da CMV trattati con valganciclovir che in pazienti sottoposti a trapianto di organo solido trattati con valganciclovir (vedere paragrafo 4.4).
Nella tabella seguente è riportata la frequenza delle reazioni avverse segnalate durante gli studi clinici con valganciclovir, ganciclovir per via orale o ganciclovir per via endovenosa. Le reazioni avverse elencate sono state segnalate nel corso di studi clinici per il trattamento di induzione e mantenimento della retinite da CMV in pazienti con AIDS, o per la profilassi della malattia da CMV in pazienti sottoposti a trapianto di fegato, rene o cuore. Nella tabella il termine (grave) tra parentesi indica che la reazione avversa è stata segnalata con quella specifica frequenza con un'intensità lieve/moderata in alcuni pazienti e grave/ potenzialmente letale in altri.
Il profilo di sicurezza complessivo di valganciclovir non è cambiato estendendo la profilassi fino a 200 giorni in pazienti adulti sottoposti a trapianto di rene ad alto rischio di malattia da CMV (D+/R-). È stata segnalata un'incidenza lievemente superiore di leucopenia nel braccio trattato per 200 giorni, mentre l'incidenza di neutropenia, anemia e trombocitopenia è risultata simile in entrambi i bracci.
b) Elenco delle reazioni avverse sotto forma di tabella
All'interno di ciascuna classe di frequenza, gli effetti indesiderati sono riportati in ordine decrescente di gravità.
|
Sistema corporeo
|
Molto
comune (≥1/10)
|
Comune (da ≥1/100 a <1/10)
|
Non comune
(da ≥1/1.000 a < 1/100)
|
Raro
(da ≥1/10.000 a < 1/1.000)
|
|
Infezioni ed infestazioni
|
|
Candidiasi orale, sepsi (batteriemia, viremia), cellulite, infezioni del tratto urinario
|
|
|
|
Patologie del sistema emolinfopoietico
|
(Grave) neutropenia, anemia
|
Anemia grave (grave), trombocitopenia (grave), leucopenia (grave), pancitopenia (grave)
|
Insufficienza midollare
|
Anemia aplastica
|
|
Disturbi del sistema immunitario
|
|
|
Reazione anafilattica
|
|
|
Disturbi del metabolismo e della nutrizione
|
|
Riduzione dell'appetito, anoressia
|
|
|
|
Disturbi psichiatrici
|
|
Depressione, ansia, confusione, alterazione del pensiero
|
Agitazione, disturbi psichiatrici, allucinazioni
|
|
|
Patologie del sistema nervoso
|
|
Cefalea, insonnia, disgeusia (alterazione del gusto), ipoestesia, parestesia, neuropatia periferica, capogiro, convulsione
|
Tremore
|
|
|
Patologie dell'occhio
|
|
Edema maculare,
distacco della retina, corpi mobili vitreali, dolore oculare
|
Disturbi della visione, congiuntivite
|
|
|
Patologie dell'orecchio e del labirinto
|
|
Mal d'orecchio
|
Sordità
|
|
|
Patologie cardiache
|
|
|
Aritmia
|
|
|
Patologie vascolari
|
|
|
Ipotensione
|
|
|
Patologie respiratorie, toraciche e mediastiniche
|
Dispnea
|
Tosse
|
|
|
|
Patologie gastrointestinali
|
Diarrea
|
Nausea, vomito, dolore addominale, dolore all'addome superiore, dispepsia, stipsi, flatulenza, disfagia
|
Distensione addominale, ulcera della bocca, pancreatite
|
|
|
Patologie epatobiliari
|
|
Alterazione della funzionalità epatica (grave), aumento della fosfatasi alcalina plasmatica, aumento dell'aspartato aminotransferasi
|
Aumento dell'alanina aminotransferasi
|
|
|
Patologie della cute e del tessuto sottocutaneo
|
|
Dermatite, sudorazione notturna, prurito
|
Alopecia, orticaria, secchezza cutanea
|
|
|
Patologie del sistema muscoloscheletrico e del tessuto connettivo
|
|
Mal di schiena, mialgia, artralgia, spasmi muscolari
|
|
|
|
Patologie renali e urinarie
|
|
Riduzione della clearance renale della creatinina, danno renale
|
Ematuria, insufficienza renale
|
|
|
Patologie dell'apparato riproduttivo e della mammella
|
|
|
Infertilità maschile
|
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione
|
|
Stanchezza, febbre, brividi, dolore, dolore al torace, malessere, astenia
|
|
|
|
Esami diagnostici
|
|
Perdita di peso, aumento della creatinina sierica
|
|
|
La trombocitopenia grave può essere associata a sanguinamenti potenzialmente pericolosi per la vita.
Il distacco di retina è stato segnalato soltanto in pazienti con AIDS trattati con valganciclovir per una retinite da CMV.
c) Popolazione pediatrica
Valganciclovir è stato studiato in 179 pazienti pediatrici sottoposti a trapianto di organo solido e a rischio di sviluppare malattia da CMV (di età compresa tra le 3 settimane e i 16 anni) e in 133 neonati con malattia da CMV congenita sintomatica (di età compresa tra i 2 e i 31 giorni), con una durata dell'esposizione al ganciclovir compresa tra i 2 e i 200 giorni.
Le reazioni avverse segnalate con maggiore frequenza durante il trattamento negli studi clinici su pazienti pediatrici sono state diarrea, nausea, neutropenia, leucopenia e anemia.
In soggetti sottoposti a trapianto di organo solido, il profilo di sicurezza complessivo nei pazienti pediatrici è risultato simile a quello degli adulti. Tuttavia, l'incidenza di alcuni eventi avversi, quali infezione delle vie aeree superiori, piressia, dolore addominale e disuria, che potrebbero essere caratteristici della popolazione pediatrica, è risultata superiore nei pazienti pediatrici rispetto agli adulti.
Anche l'incidenza di neutropenia è risultata lievemente superiore nei due studi condotti su pazienti pediatrici sottoposti a trapianto di organo solido rispetto agli adulti, ma non è emersa una correlazione tra neutropenia ed eventi avversi infettivi nella popolazione pediatrica.
In pazienti pediatrici sottoposti a trapianto di rene, il prolungamento dell'esposizione al valganciclovir fino a 200 giorni non si è associato a un aumento complessivo dell'incidenza di eventi avversi. L'incidenza di neutropenia grave (ANC < 500/μl) è risultata superiore nei pazienti pediatrici sottoposti a trapianto di rene trattati fino a 200 giorni rispetto ai pazienti pediatrici trattati fino a 100 giorni e rispetto a pazienti adulti sottoposti a trapianto di rene trattati fino a 100 o fino a 200 giorni (vedere paragrafo 4.4).
Sono disponibili soltanto dati limitati relativi a neonati o lattanti con infezione da CMV congenita sintomatica trattati con valganciclovir; tuttavia, la sicurezza sembra in linea con il profilo di sicurezza noto di valganciclovir/ganciclovir.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all'indirizzo www.agenziafarmaco.gov.it/it/responsabili.
Sovradosaggio
Cosa fare se avete preso una dose eccessiva di Valganciclovir Sandoz
Esperienze di sovradosaggio con valganciclovir
Un adulto ha sviluppato una depressione midollare fatale (aplasia midollare) dopo diversi giorni di terapia con dosaggi almeno 10 volte superiori a quelli raccomandati per il grado di danno renale del paziente (diminuzione della clearance della creatinina).
È possibile che un sovradosaggio di valganciclovir possa anche portare ad un aumento della tossicità renale (vedere paragrafi 4.2 e 4.4).
In pazienti che ricevono un sovradosaggio di valganciclovir, l'emodialisi e l'idratazione possono essere di beneficio nel ridurre i livelli plasmatici circolanti del farmaco (vedere paragrafo 5.2).
Esperienze di sovradosaggio con ganciclovir per via endovenosa
Durante studi clinici e post-marketing sono stati riportati casi di sovradosaggio con ganciclovir per via endovenosa. In alcuni di questi casi non sono stati riferiti effetti collaterali. La maggior parte dei pazienti ha presentato uno o più dei seguenti eventi avversi:
- tossicità ematologica: pancitopenia, depressione midollare, aplasia midollare, leucopenia, neutropenia, granulocitopenia.
- tossicità epatica: epatiti, disordini della funzionalità epatica.
- tossicità renale: peggioramento dell'ematuria in un paziente con preesistente danno renale, insufficienza renale acuta, aumento della creatinina.
- tossicità gastrointestinale: dolore addominale, diarrea, vomito.
- tossicità neurologica: tremore generalizzato, convulsioni.
Scadenza
3 anni
Flaconi:
Dopo prima apertura: 2 mesi
Conservazione
Questo medicinale non richiede alcuna condizione particolare di conservazione.
Farmaci Equivalenti
I farmaci equivalenti di
Valganciclovir Sandoz a base di
Valganciclovir Cloridrato sono:
Valcyte - Compressa Rivestita, Valcyte - Polvere, Valganciclovir Accord, Valganciclovir Aurobindo, Valganciclovir Mylan, Valganciclovir Teva
Foglietto Illustrativo
Fonti Ufficiali
© 2022 EDRA S.p.A. - P.iva 08056040960
DPO - dpo@lswr.it