Neuraceq
Ultimo aggiornamento: 20/07/2021
Cos'è Neuraceq?
Neuraceq è un farmaco a base del principio attivo
Florbetaben (18f), appartenente alla categoria degli
Diagnostici e nello specifico
Altri radiofarmaceutici diagnostici del sistema nervoso centrale. E' commercializzato in Italia dall'azienda
Piramal Imaging Limited.
Neuraceq può essere prescritto con Ricetta OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile.
Neuraceq può essere prescritto con Ricetta OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile.
Confezioni
Neuraceq 300 Mbq/ml soluzione iniettabile ev 1 flacone monodose
Informazioni commerciali sulla prescrizione
Titolare: Piramal Imaging Limited
Ricetta: OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile
Classe: C
Principio attivo: Florbetaben (18f)
Gruppo terapeutico: Diagnostici
ATC: V09AX06 - florbetaben (18F)
Forma farmaceutica: soluzione
Ricetta: OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile
Classe: C
Principio attivo: Florbetaben (18f)
Gruppo terapeutico: Diagnostici
ATC: V09AX06 - florbetaben (18F)
Forma farmaceutica: soluzione
Se sei un professionista, potrai trovare le schede tecniche complete e molto altro nell'area riservata di Codifa.it
Indicazioni
Perché si usa Neuraceq? A cosa serve?
Medicinale solo per uso diagnostico.
Neuraceq è un radiofarmaco indicato per la visualizzazione con la tomografia ad emissione di positroni (PET) della densità delle placche neuritiche di β-amiloide nel cervello di pazienti adulti con decadimento cognitivo che vengono valutati per la malattia di Alzheimer (AD) e altre cause di decadimento cognitivo. Neuraceq deve essere usato congiuntamente alla valutazione clinica.
Una scansione negativa indica placche scarse o assenti, il che non è compatibile con una diagnosi di AD. Per le limitazioni dell'interpretazione di una scansione positiva vedere paragrafi 4.4 e 5.1.
Posologia
Come usare Neuraceq: Posologia
Una scansione PET con florbetaben (18F) deve essere richiesta da medici con esperienza nella gestione clinica delle patologie neurodegenerative.
Le immagini ottenute con Neuraceq devono essere interpretate solo da valutatori che hanno effettuato un training su come interpretare le immagini PET con florbetaben (18F). Si raccomanda l'utilizzo di un esame recente del paziente con tomografia assiale computerizzata (TAC) o risonanza magnetica (RM), co-registrato, per ottenere un'immagine combinata PET-TAC o PET-MR in casi di incertezza sulla localizzazione della sostanza grigia e del margine sostanza grigia/bianca nella scansione PET (vedere paragrafo 4.4. Interpretazione delle immagini di Neuraceq).
Posologia
L'attività raccomandata per un adulto è 300 MBq di florbetaben (18F). La dose massima non deve superare 360 MBq e non deve essere inferiore a 240 MBq al momento della somministrazione. Il volume di Neuraceq da iniettare può variare da 0,5 a 10 mL per fornire l'attività target di 300 MBq al momento della somministrazione endovenosa.
Popolazioni particolari
Anziani
Non è raccomandato alcun aggiustamento della dose in base all'età.
Insufficienza renale ed epatica
È richiesta un'attenta valutazione dell'attività da somministrare poichè in questi pazienti è possibile un'aumentata esposizione alle radiazioni. Vedere paragrafo 4.4.
Non sono stati effettuati studi estesi per determinare il range e l'aggiustamento della dose del medicinale in popolazioni normali e speciali. La farmacocinetica di florbetaben (18F) non è stata caratterizzata in pazienti con compromissione renale o epatica.
Popolazione pediatrica
Non vi è un uso rilevante di Neuraceq nella popolazione pediatrica.
Modo di somministrazione
Neuraceq è per uso endovenoso ed è per uso multidose.
L'attività di florbetaben (18F) deve essere misurata con un calibratore di dose immediatamente prima dell'iniezione.
Florbetaben (18F) non deve essere diluito.
La dose è somministrata mediante iniezione endovenosa lenta in bolo (6 sec/mL) seguita da un lavaggio con circa 10 mL di una soluzione iniettabile di cloruro di sodio 9 mg/mL (0,9%) per assicurare una completa erogazione della dose. Se il volume dell'iniezione varia tra 0,5 e 1 mL, devono essere utilizzate soltanto siringhe di misura appropriata (1 mL), e la siringa deve essere lavata con una soluzione di cloruro di sodio (vedere paragrafo 12) per completare l'erogazione della dose.
L'iniezione di florbetaben (18F) deve essere endovenosa per evitare sia l'irradiazione provocata da stravaso locale che artefatti dell'immagine.
Acquisizione dell'immagine
Deve essere acquisita un'immagine PET di 20 minuti iniziando circa 90 minuti dopo l'iniezione endovenosa di florbetaben (18F).
I pazienti devono stare in posizione supina con la testa posizionata in modo da centrare il cervello, compreso il cervelletto, nel campo di visuale dello scanner PET. Per ridurre il movimento della testa può essere utilizzato del nastro adesivo o un altro sistema di contenimento flessibile. La ricostruzione deve comprendere la correzione dell'attenuazione per avere pixel trans-assiali di dimensioni comprese tra 2,0 e 3,0 mm.
Controindicazioni
Quando non dev'essere usato Neuraceq
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
Avvertenze speciali e precauzioni di impiego
Cosa serve sapere prima di prendere Neuraceq
Giustificazione per il beneficio/rischio individuale
Per ciascun paziente l'esposizione alle radiazioni deve essere giustificata sulla base del possibile beneficio. L'attività somministrata deve, in ogni caso, essere la più bassa possibile per ottenere le informazioni diagnostiche richieste.
Compromissione renale e compromissione epatica
È richiesta un'attenta valutazione del rapporto beneficio/rischio in questi pazienti poichè è possibile che l'esposizione alle radiazioni risulti aumentata. Florbetaben (18F) è escreto principalmente attraverso il sistema epatobiliare e per i pazienti con compromissione epatica vi è la possibilità di un'aumentata esposizione alle radiazioni. Vedere paragrafo 4.2.
Popolazione pediatrica
Per le informazioni sull'utilizzo nella popolazione pediatrica vedere paragrafi 4.2 o 5.1.
Interpretazioni delle immagini di Neuraceq
Le immagini ottenute con Neuraceq devono essere interpretate solo da valutatori che hanno effettuato un training su come interpretare le immagini PET con florbetaben (18F).
Una scansione negativa indica una densità scarsa o assente di placche corticali di ß-amiloide. Una scansione positiva indica una densità da moderata a frequente. Sono stati osservati errori di interpretazione dell'immagine nella stima della densità delle placche cerebrali neuritiche di β- amiloide, compresi falsi negativi e falsi positivi.
Le immagini PET sono lette con un orientamento trans-assiale usando una scala del grigio. Il lettore deve confrontare l'intensità del segnale della sostanza grigia corticale con l'intensità massima del segnale della sostanza bianca. Le immagini devono essere osservate in maniera sistematica (Figura 1) iniziando al livello del cervelletto e scorrendo verso l'alto attraverso i lobi temporale laterale e frontale, poi verso l'area della corteccia cingolata posteriore e il precuneo ed infine verso il lobo parietale.
L'interpretazione delle immagini è fatta visivamente confrontando l'attività nella sostanza grigia corticale con l'attività della sostanza bianca corticale adiacente. Ognuna di queste regioni del cervello, la temporale laterale, la frontale, il cingolato posteriore, il precuneo e i lobi parietali devono essere valutati visivamente in modo sistematico e devono essere marcati in base al punteggio di captazione del tracciante nella regione corticale (RCTU) (Tabella 1).
Tabella 1: Definizioni della captazione del tracciante nella regione corticale (RCTU, regional cortical tracer uptake)
|
Punteggio della captazione del tracciante nella regione corticale
|
Condizione per l'assegnazione
|
|
1 (Nessuna captazione del tracciante)
|
La captazione del tracciante (cioè l'intensità del segnale) nella sostanza grigia della regione è inferiore rispetto alla sostanza bianca.
|
|
2 (Captazione del tracciante moderata)
|
Area o aree più piccole di captazione del tracciante uguali o superiori a quelle presenti nella sostanza bianca: che si estendono oltre il bordo della sostanza bianca verso il margine esterno corticale, coinvolgendo la maggior parte delle sezioni all'interno della rispettiva regione.
|
|
3 (Captazione del tracciante pronunciato)
|
Una ampia area confluente di captazione del tracciante uguale o superiore a quella presente nella sostanza bianca: che si estende oltre il bordo della sostanza bianca verso il margine esterno corticale e che coinvolge l'intera regione, compresa la maggior parte delle sezioni all'interno della rispettiva regione.
|
Nota: per un punteggio di captazione del tracciante nella corteccia, la captazione deve essere presente nella maggior parte delle sezioni all'interno della regione in questione.
Figura 1: Casi di PET con Neuraceq che mostrano esempi di scansione negativa con florbetaben (18F) (fila in alto) e di scansione positiva (fila in basso).
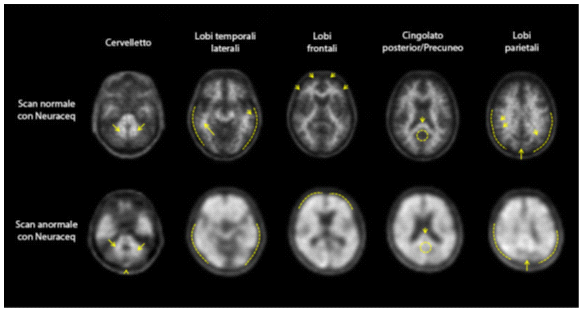
La decisione complessiva che scaturisce dalla valutazione visiva della scansione PET è soggettiva e basata su un risultato binario dato come "positivo" o " negativo". Un soggetto è classificato come "positivo" o "negativo" in base al punteggio del carico di placche amiloidi cerebrali (BAPL) (Tabella 2) che deriva dai punteggi RCTU nelle quattro regioni del cervello (Tabella 1).
Tabella 2: Definizioni del carico di placche amiloidi cerebrali (BAPL, brain amyloid plaque load)
|
Assegnazione
|
Punteggio BAPL
|
Regola per l'assegnazione
|
|||
|
Scansione negativa
|
1
|
Scansione senza deposizione di beta- amiloide
|
Punteggio RCTU 1 in ciascuna delle 4 regioni del cervello (lobi laterali temporali, lobi frontali, cingolato posteriore/precuneo, lobi parietali)
|
||
|
Scansione positiva
|
2
|
Scansione con deposizione di beta- amiloide moderata
|
Punteggio RCTU 2 in una qualsiasi o tutte le regioni del cervello e nessun punteggio 3 in queste 4 regioni
|
||
| 3 |
Scansione con deposizione di beta- amiloide pronunciata |
Punteggio RCTU 3 in almeno una delle
4 regioni del cervello
|
|||
Limiti di utilizzo
Una scansione positiva non stabilisce in modo indipendente una diagnosi di AD o di altri disturbi cognitivi poichè la deposizione di una placca neuritica nella sostanza grigia può essere presente negli anziani asintomatici e in alcune demenze neurodegenerative (malattia di Alzheimer, demenza da corpi di Lewy, demenza da morbo di Parkinson).
Per le limitazioni di utilizzo nei pazienti con deterioramento cognitivo lieve (Mild Cognitive Impairment, MCI) vedere paragrafo 5.1.
L'efficacia di florbetaben (18F) nel prevedere lo sviluppo di AD o nel monitorare la risposta alla terapia non è stata stabilita (vedere paragrafo 5.1).
Alcune scansioni possono essere difficili da interpretare a causa del rumore di fondo dell'immagine, della atrofia con assottigliamento corticale o di sfocature dell'immagine, che possono portare ad errori di interpretazione. Nei casi in cui vi è incertezza sulla localizzazione della sostanza grigia e margine della sostanza grigia/bianca sulla scansione PET, ed è disponibile un'immagine recente co-registrata di una TAC o RM, chi effettua l'interpretazione deve esaminare l'immagine combinata PET-TAC o PET-RM per chiarire la correlazione tra il reperto della PET e l'anatomia della sostanza grigia.
È stata identificata un'aumentata captazione in strutture extracerebrali come viso, cuoio capelluto e ossa in alcuni casi. A volte può essere osservata un'attività residua nel seno medio sagittale (vedere paragrafo 5.2).
Dopo la procedura
Il contatto ravvicinato con bambini e donne in stato di gravidanza deve essere limitato durante le prime 24 ore successive all'iniezione.
Avvertenze specifiche
Questo medicinale contiene fino a 1,5 mmol di sodio (cioè 33 mg) per dose. Questo deve essere tenuto in considerazione in pazienti sottoposti a dieta a basso contenuto di sodio.
Questo medicinale contiene il 15% in volume di etanolo (alcol), cioè fino a 1,2 g per dose equivalenti a 30 mL di birra o a 12,5 mL di vino. Questo può essere pericoloso per coloro che soffrono di alcolismo, e deve anche essere preso in considerazione nelle donne in stato di gravidanza o che allattano e in gruppi ad alto rischio quali pazienti con malattia epatica o epilessia.
Per le precauzioni riguardanti il rischio ambientale vedere paragrafo 6.6.
Interazioni con altri medicinali e altre forme di interazione
Quali farmaci o alimenti possono modificare l'effetto di Neuraceq
Non sono stati effettuati studi d'interazione in vivo.
Nei dosaggi di binding con ligando radioattivo non è stato trovato un legame significativo usando un ampio pannello di recettori animali ed umani, canali ionici e trasportatori.
Studi in vitro usando microsomi epatici umani, non hanno indicato alcun potenziale di inibizione del sistema enzimatico citocromo P450.
Fertilità, gravidanza e allattamento
Donne potenzialmente fertili
Quando è prevista la somministrazione di radiofarmaci ad una donna potenzialmente fertile, è importante determinare se è o non è in stato di gravidanza. Ove non sia provato il contrario, qualsiasi donna che abbia saltato un ciclo mestruale deve essere considerata in stato di gravidanza. In caso di dubbi riguardo ad una possibile gravidanza (se la donna ha saltato un ciclo mestruale, se il ciclo mestruale è molto irregolare, etc.), devono essere proposte alla paziente tecniche alternative che non utilizzino radiazioni ionizzanti (se disponibili).
Gravidanza:
Le metodiche che utilizzano radionuclidi impiegate su donne in stato di gravidanza generano radiazioni che coinvolgono il feto. Pertanto, durante la gravidanza devono essere eseguiti soltanto gli esami ritenuti essenziali, quando il probabile beneficio supera di gran lunga il rischio per la madre e per il feto.
Non sono stati condotti studi nelle donne in stato di gravidanza. Non sono stati eseguiti studi negli animali per valutare gli effetti di florbetaben (18F) sulla riproduzione (vedere paragrafo 5.3.)
Allattamento
Non è noto se florbetaben (18F) sia escreto nel latte materno durante l'allattamento. Prima di somministrare radiofarmaci ad una madre che sta allattando, si deve valutare la possibilità di ritardare la somministrazione del radionuclide fino a quando la madre abbia terminato l'allattamento e considerare se sia stato scelto il radiofarmaco più appropriato tenendo presente l'eliminazione di attività nel latte materno. Se la somministrazione è ritenuta necessaria, l'allattamento deve essere interrotto per 24 ore e il latte prodotto deve essere eliminato.
Il contatto ravvicinato con bambini deve essere limitato durante le prime 24 ore successive all'iniezione.
Fertilità
Non sono stati svolti studi sulla fertilità.
Effetti sulla capacità di guidare veicoli e sull'uso di macchinari
Neuraceq non ha influenze note sulla capacità di guidare veicoli o di usare macchinari.
Effetti indesiderati
Quali sono gli effetti collaterali di Neuraceq
Riassunto del profilo di sicurezza
Il profilo di sicurezza generale di Neuraceq è basato sui dati provenienti da 1090 somministrazioni di Neuraceq a 872 soggetti e da12 soggetti che hanno ricevuto il veicolo. Dosaggi ripetuti ad intervalli annuali hanno mostrato che non vi erano differenze nel profilo di sicurezza dopo il primo, secondo o terzo dosaggio.
Elenco degli effetti indesiderati
La frequenza è definita come: molto comune (≥1/10), comune (da ≥1/100 a <1/10), non comune (da ≥1/1.000 a <1/100), rara (da ≥1/10.000 a <1/1.000), molto rara (<1/10,000), non nota (non può essere definita sulla base dei dati disponibili). Sebbene si possano in realtà verificare con frequenze inferiori a quelle indicate di seguito, la dimensione del database di origine non ha permesso l'assegnazione a categorie di frequenza inferiori alla categoria "non comune" (da ≥1/1.000 a <1/100).
Patologie del sistema nervoso
Non comune: sensazione di bruciore, cefalea, nevralgia, tremore
Patologie vascolari
Non comune: vampate, ematoma, ipotensione
Patologie gastrointestinali
Non comune: diarrea, nausea
Patologie epatobiliari
Non comune: funzione epatica anormale
Patologie della cute e del tessuto sottocutaneo
Non comune: iperidrosi, eruzione cutanea, eruzione cutanea tossica
Patologie del sistema muscolo-scheletrico e del tessuto connettivo
Non comune: fastidio agli arti, dolore alle estremità
Patologie sistemiche e condizioni relative alla sede di somministrazione
Comune: irritazione in sede di iniezione, dolore in sede di iniezione, eritema in sede di iniezione/applicazione
Non comune: dolore nella sede del catetere, fastidio in sede di iniezione, ematoma in sede di iniezione, calore in sede di iniezione, reazione in sede di puntura, dolore in sede di puntura del vaso, affaticamento, sensazione di calore, piressia
Esami diagnostici
Non comune: aumento della creatinina ematica
L'esposizione a radiazioni ionizzanti è legata all'induzione di cancro e al potenziale sviluppo di difetti ereditari. Poiché quando viene somministrata la massima attività raccomandata di 300 MBq di florbetaben (18F) la dose efficace è 5,8 mSv, è previsto che queste reazioni avverse si verifichino con una bassa probabilità.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione riportato nell'Allegato V.
Sovradosaggio
Cosa fare se avete preso una dose eccessiva di Neuraceq
A causa della piccola quantità di florbetaben (18F) in ciascuna dose, non è previsto che il sovradosaggio provochi effetti farmacologici. In caso di somministrazione di un sovradosaggio di radiazione, la dose assorbita dal paziente deve essere ridotta laddove possibile aumentando l'eliminazione del radionuclide dall'organismo mediante frequente minzione e defecazione. Può essere utile stimare la dose efficace che era stata applicata.
Scadenza
Fino a 10 ore dalla fine della sintesi
Conservazione
Questo medicinale non richiede alcuna condizione particolare di conservazione.
I radiofarmaci devono essere conservati in conformità alle normative nazionali sui materiali radioattivi.
Foglietto Illustrativo
Fonti Ufficiali
© 2022 EDRA S.p.A. - P.iva 08056040960
DPO - dpo@lswr.it