Empliciti
Ultimo aggiornamento: 15/03/2022
Cos'è Empliciti?
Empliciti è un farmaco a base del principio attivo
Elotuzumab, appartenente alla categoria degli
Antineoplastici, anticorpi monoclonali e nello specifico
Altri anticorpi monoclonali e coniugati anticorpo farmaco. E' commercializzato in Italia dall'azienda
Bristol-Myers Squibb S.r.l..
Empliciti può essere prescritto con Ricetta OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile.
Empliciti può essere prescritto con Ricetta OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile.
Confezioni
Empliciti 300 mg polvere per concentrato per soluz. per infusione 1 flaconcino
Empliciti 400 mg polvere per concentrato per soluz. per infusione 1 flaconcino
Empliciti 400 mg polvere per concentrato per soluz. per infusione 1 flaconcino
Informazioni commerciali sulla prescrizione
Titolare: Bristol-Myers Squibb Pharma EEIG
Concessionario: Bristol-Myers Squibb S.r.l.
Ricetta: OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile
Classe: H
Principio attivo: Elotuzumab
Gruppo terapeutico: Antineoplastici, anticorpi monoclonali
ATC: L01FX08 - Elotuzumab
Forma farmaceutica: Polvere
Concessionario: Bristol-Myers Squibb S.r.l.
Ricetta: OSP - medicinali soggetti a prescrizione medica limitativa, utilizzabili esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile
Classe: H
Principio attivo: Elotuzumab
Gruppo terapeutico: Antineoplastici, anticorpi monoclonali
ATC: L01FX08 - Elotuzumab
Forma farmaceutica: Polvere
Se sei un professionista, potrai trovare le schede tecniche complete e molto altro nell'area riservata di Codifa.it
Indicazioni
Perché si usa Empliciti? A cosa serve?
Empliciti è indicato in combinazione con lenalidomide e desametasone per il trattamento del mieloma multiplo in pazienti adulti che hanno ricevuto almeno una linea di terapia precedente (vedere paragrafi 4.2 e 5.1).
Posologia
Come usare Empliciti: Posologia
La terapia con Elotuzumab deve essere iniziata e monitorata da medici esperti nel trattamento del mieloma multiplo.
Premedicazione per la prevenzione delle reazioni infusionali
La seguente terapia di premedicazione deve essere somministrata ai pazienti 45-90 minuti prima dell'infusione di Empliciti (vedere paragrafo 4.4):
Desametasone 8 mg per via endovenosa
H1 antagonista: difenidramina (25-50 mg per via orale o per via endovenosa) o un H1 antagonista equivalente.
H2 antagonista: ranitidina (50 mg per via endovenosa o 150 mg per via orale) o un H2 antagonista equivalente.
Paracetamolo (650-1000 mg per via orale).
Gestione delle reazioni infusionali
Se durante la somministrazione di Empliciti dovesse manifestarsi una reazione infusionale di Grado ≥ 2, l'infusione deve essere interrotta. Successivamente alla risoluzione ad un Grado ≤ 1, la somministrazione di Empliciti deve essere nuovamente iniziata ad una velocità di 0,5 ml/min e, se tollerata, la velocità può essere aumentata gradualmente di 0,5 ml/min ogni 30 minuti fino al raggiungimento della velocità alla quale si è manifestata la reazione infusionale. Se non vi è una ricomparsa della reazione infusionale, è possibile riprendere ad aumentare la velocità di infusione (vedere Tabella 2).
Nei pazienti che manifestano una reazione infusionale, i parametri vitali devono essere monitorati ogni 30 minuti per 2 ore dopo il completamento dell'infusione di Empliciti. Nel caso in cui si verifichi una recidiva della reazione infusionale, l'infusione di Empliciti deve essere sospesa e non deve essere re-iniziata nello stesso giorno (vedere paragrafo 4.4). Reazioni infusionali molto gravi (Grado ≥ 3) possono richiedere l'interruzione permanente della terapia con Empliciti e necessitare di un trattamento di emergenza.
Posologia per la somministrazione con lenalidomide e desametasone
Lo schema posologico è riportato nella Tabella 1.
Il trattamento deve essere continuato fino a progressione della malattia o allo sviluppo di tossicità inaccettabile.
La dose raccomandata di Empliciti è di 10 mg/kg somministrata per via endovenosa ogni settimana (ciclo di 28 giorni), nei giorni 1, 8, 15 e 22 per i primi due cicli e successivamente ogni 2 settimane nei giorni 1 e 15.
La dose raccomandata di lenalidomide è di 25 mg per via orale una volta al giorno nei giorni 1-21 di cicli ripetuti di 28 giorni e, quando è somministrata nello stesso giorno, almeno 2 ore dopo l'infusione di Empliciti.
Il desametasone va somministrato come segue:
- nei giorni in cui Empliciti è somministrato (1, 8, 15 e 22 di cicli ripetuti di 28 giorni), il desametasone deve essere somministrato per via orale alla dose di 28 mg una volta al giorno dalle 3 alle 24 ore prima dell'infusione di Empliciti, più 8 mg per via endovenosa dai 45 ai 90 minuti prima di Empliciti;
- nei giorni in cui Empliciti non è somministrato ma è prevista una dose di desametasone(Giorni 8 e 22 del ciclo 3 e di tutti i cicli successivi), il desametasone deve essere somministrato per via orale alla dose di 40 mg.
|
Ciclo
|
Cicli 1 e 2 di 28 giorni
|
Cicli 3+ di 28 giorni
|
||||||
|
Giorno del ciclo
|
1
|
8
|
15
|
22
|
1
|
8
|
15
|
22
|
|
Premedicazione
|
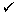 |
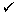 |
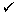 |
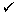 |
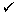 |
|
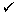 |
|
|
Empliciti (mg/kg) per via endovenosa
|
10
|
10
|
10
|
10
|
10
|
|
10
|
|
|
Lenalidomide (25 mg) per via orale
|
Giorni 1-21
|
Giorni 1-21
|
||||||
|
Desametasone (mg) per via orale
|
28
|
28
|
28
|
28
|
28
|
40
|
28
|
40
|
|
Giorno del ciclo
|
1
|
8
|
15
|
22
|
1
|
8
|
15
|
22
|
Per informazioni aggiuntive concernenti lenalidomide e desametasone, consultare il Riassunto delle Caratteristiche del Prodotto corrispondente.
Per le istruzioni sulla velocità d'infusione, vedere la sezione seguente Modo di somministrazione.
Ritardo, interruzione o sospensione della somministrazione della dose
Nel caso in cui la somministrazione della dose di uno dei medicinali inclusi nel regime di associazione è ritardata, interrotta o sospesa, il trattamento con gli altri medicinali può continuare come previsto. Tuttavia, se la somministrazione orale o endovenosa di desametasone è ritardata o sospesa, la decisione di somministrare Empliciti deve essere basata sul giudizio clinico (p.e. rischio di ipersensibilità) (vedere paragrafo 4.4).
Popolazioni speciali
Popolazione pediatrica
Non esiste un uso rilevante di Empliciti nella popolazione pediatrica per l'indicazione nel mieloma multiplo.
Anziani
Nei pazienti di età superiore a 65 anni non è richiesto alcun aggiustamento della dose di elotuzumab (vedere paragrafo 5.2). I dati di efficacia e sicurezza di elotuzumab nei pazienti con età ≥ 85 anni sono molto limitati.
Compromissione renale
Nessun aggiustamento della dose di Empliciti è richiesto per pazienti con compromissione renale lieve (CrCl = 60 - 89 ml/min), moderata (CrCl = 30 - 59 ml/min), grave (CrCl < 30 ml/min) o malattia renale in fase terminale che richiede dialisi (vedere paragrafo 5.2).
Compromissione epatica
Nessun aggiustamento della dose di Empliciti è richiesto per pazienti con compromissione epatica lieve (bilirubina totale [BT] ≤ limite superiore della norma [LSN] e AST > LSN o BT da <1 a 1,5 × LSN e qualsiasi valore di AST). Empliciti non è stato studiato in pazienti con compromissione epatica moderata (BT da > 1,5 a 3 × LSN e qualsiasi valore di AST) o grave (BT > 3 × LSN e qualsiasi valore di AST) (vedere paragrafo 5.2).
Modo di somministrazione
Empliciti è esclusivamente per uso endovenoso.
La somministrazione della soluzione ricostituita e diluita deve essere iniziata ad una velocità d'infusione di 0,5 ml/min. Se l'infusione è ben tollerata, la velocità d'infusione può essere aumentata gradualmente come descritto nella Tabella 2. La velocità massima d'infusione non deve superare i 5 ml/min.
Tabella 2: Velocità d'infusione di Empliciti
| Ciclo1, Dose 1 | Ciclo 1, Dose 2 |
Ciclo 1, Dose 3 e 4 e tutti i Cicli successivi |
|||
|
Intervallo di tempo |
Velocità |
Intervallo di tempo |
Velocità | Velocità | |
| 0 - 30 min | 0,5 ml/min | 0 - 30 min | 3 ml/min | 5 ml/min* |
|
| 30 - 60 min | 1 ml/min | ≥ 30 min | 4 ml/min* | ||
| ≥ 60 min | 2 ml/min* | - | - | ||
* Continuare a questa velocità fino al completamento dell'infusione, per approssimativamente 1 ora in base al peso del paziente.
Per le istruzioni sulla ricostituzione e sulla diluizione di Empliciti prima della somministrazione, vedere paragrafo 6.6.
Controindicazioni
Quando non dev'essere usato Empliciti
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1. Prima di iniziare la terapia è necessario consultare il Riassunto delle Caratteristiche del Prodotto di tutti i medicinali usati in combinazione con Empliciti.
Avvertenze speciali e precauzioni di impiego
Cosa serve sapere prima di prendere Empliciti
Reazioni infusionali
Reazioni infusionali sono state segnalate in pazienti a cui è stato somministrato Elotuzumab (vedere paragrafo 4.8).
Prima dell'infusione di Empliciti, deve essere somministrata una terapia di premedicazione consistente in desametasone, H1 antagonista, H2 antagonista e paracetamolo (vedere paragrafo 4.2 Premedicazione). L'incidenza delle reazioni infusionali è stata molto più elevata nei pazienti non sottoposti a premedicazione.
Se uno qualsiasi dei sintomi di una reazione infusionale raggiunge un Grado ≥ 2, l'infusione di Empliciti deve essere interrotta e deve essere iniziata un'appropriata terapia medica e di supporto. I parametri vitali devono essere monitorati ogni 30 minuti per 2 ore dopo la conclusione dell'infusione di Empliciti. Quando la reazione si è risolta (sintomi di Grado ≤ 1), l'infusione di Empliciti può essere nuovamente ripresa alla velocità iniziale d'infusione di 0,5 ml/min. Se i sintomi non si ripresentano, la velocità d'infusione può essere gradualmente aumentata ogni 30 minuti fino ad un massimo di 5 ml/min (vedere paragrafo 4.2 Modo di somministrazione).
Le reazioni infusionali molto gravi possono richiedere l'interruzione permanente della terapia con Empliciti e necessitare di un trattamento di emergenza. Nei pazienti con reazioni infusionali lievi o moderate Empliciti può essere somministrato ad una velocità d'infusione ridotta e sotto stretto monitoraggio (vedere paragrafo 4.2 Modo di somministrazione).
Condizioni di utilizzo dei medicinali usati con Empliciti
Empliciti è usato in combinazione con altri medicinali; pertanto le condizioni di utilizzo applicabili a questi medicinali si applicano anche alla terapia di combinazione. Prima di iniziare la terapia, è necessario consultare il Riassunto delle Caratteristiche del Prodotto di tutti i medicinali usati in combinazione con Empliciti.
Infezioni
Negli studi clinici condotti in pazienti con mieloma multiplo, l'incidenza di tutte le infezioni, inclusa l'infezione polmonare, è stata più elevata nei pazienti trattati con Empliciti (vedere paragrafo 4.8). I pazienti devono essere monitorati e le infezioni trattate con terapie standard.
Secondi tumori primari (SPM)
In uno studio clinico condotto in pazienti con mieloma multiplo che ha confrontato un trattamento con Empliciti in combinazione con lenalidomide e desametasone con un trattamento con lenalidomide e desametasone (Studio 1), l'incidenza di SPM, e specificamente di tumori solidi e di carcinoma cutaneo di tipo non melanoma, è stata più elevata nei pazienti trattati con Empliciti (vedere paragrafo 4.8). È noto che l'esposizione alla lenalidomide è associata alla comparsa di SPM, e tale esposizione è risultata prolungata nei pazienti trattati con Empliciti in combinazione con lenalidomide e desametasone rispetto a pazienti trattati con lenalidomide e desametasone. L'incidenza delle neoplasie ematologiche è risultata la stessa nei due bracci di trattamento. I pazienti devono essere tenuti sotto controllo per lo sviluppo di SPM.
Interazioni con altri medicinali e altre forme di interazione
Quali farmaci o alimenti possono modificare l'effetto di Empliciti
Non sono stati condotti studi d'interazione farmacocinetica. Non si prevede che Empliciti, un anticorpo monoclonale umanizzato, sia metabolizzato dagli enzimi del citocromo P450 (CYP) o da altri enzimi che metabolizzano i farmaci e non si prevede che l'inibizione o l'induzione di questi enzimi da parte dei medicinali co-somministrati influisca sulla farmacocinetica di Empliciti.
Empliciti può essere rilevato nell'elettroforesi delle proteine sieriche (SPEP) e nell'immunofissazione sierica nei pazienti affetti da mieloma e potrebbe interferire con una corretta classificazione della risposta alla terapia. La presenza di elotuzumab nel siero del paziente può determinare la comparsa di un piccolo picco nella regione pre-gamma della SPEP, che risulta di tipo IgG? all'immunofissazione sierica. Questa interferenza può influire sulla determinazione della risposta completa e di una possibile recidiva dopo risposta completa nei pazienti affetti da mieloma multiplo con componente monoclonale di tipo IgG kappa.
In caso di rilevazione di picchi aggiuntivi all'immunofissazione sierica, la possibile presenza di una gammopatia biclonale deve essere esclusa.
Prima di iniziare la terapia, è necessario consultare il Riassunto delle Caratteristiche del Prodotto di tutti i medicinali usati in combinazione con Empliciti.
Fertilità, gravidanza e allattamento
Donne in età fertile/Contraccezione maschile e femminile
Empliciti non deve essere usato in donne in età fertile, tranne nel caso in cui il trattamento con Elotuzumab sia reso necessario dalle condizioni cliniche della donna. Le donne in età fertile devono usare misure contraccettive efficaci.
I pazienti di sesso maschile devono usare misure contraccettive efficaci per tutta la durata del trattamento e nei 180 giorni successivi se la loro partner è in gravidanza o in età fertile e non sta usando misure contraccettive efficaci.
Gravidanza
Nell'uomo non vi sono esperienze con elotuzumab durante la gravidanza. Elotuzumab sarà somministrato in combinazione con la lenalidomide che è controindicata durante la gravidanza. Non sono presenti dati sugli animali riguardanti l'effetto di elotuzumab sulla tossicità riproduttiva, a causa della mancanza di un adeguato modello animale. Empliciti non deve essere usato durante la gravidanza, tranne nel caso in cui il trattamento con elotuzumab sia reso necessario dalle condizioni cliniche della donna.
Prima di iniziare la terapia, è necessario consultare il Riassunto delle Caratteristiche del Prodotto di tutti i medicinali usati in combinazione con Empliciti. Quando Empliciti è usato con la lenalidomide, sussiste un rischio di danno fetale, che include nell'uomo gravi difetti congeniti e potenzialmente letali associati a questi agenti; ed è necessario osservare i dettami riguardanti la prevenzione della gravidanza, incluso l'utilizzo di test di gravidanza e di misure contraccettive. La lenalidomide è presente nel sangue e nello sperma di pazienti che ricevono il medicinale. Fare riferimento al Riassunto delle Caratteristiche del Prodotto per i dettami riguardanti la contraccezione a causa della presenza e della trasmissione nello sperma, e per informazioni più dettagliate. I pazienti che ricevono Empliciti in combinazione con la lenalidomide devono aderire al programma di prevenzione della gravidanza di lenalidomide.
Allattamento
Non si prevede che elotuzumab sia escreto nel latte materno. Elotuzumab sarà somministrato in combinazione con la lenalidomide; l'allattamento deve essere interrotto a causa dell'uso della lenalidomide.
Fertilità
Non sono stati condotti studi per valutare l'effetto di elotuzumab sulla fertilità. Pertanto, l'effetto di elotuzumab sulla fertilità maschile e femminile non è noto.
Effetti sulla capacità di guidare veicoli e sull'uso di macchinari
Sulla base delle reazioni avverse segnalate, è improbabile che Empliciti influisca negativamente sulla capacità di guidare veicoli o di usare macchinari. I pazienti che manifestano reazioni infusionali devono essere avvertiti di non guidare veicoli o usare macchinari fino alla risoluzione dei sintomi.
Effetti indesiderati
Quali sono gli effetti collaterali di Empliciti
Sintesi del profilo di sicurezza
I dati di sicurezza di Elotuzumab sono stati valutati su un totale di 554 pazienti con mieloma multiplo trattati con elotuzumab in combinazione con lenalidomide e desametasone (451 pazienti) o con bortezomib e desametasone (103 pazienti) ed aggregati da 6 studi clinici. La maggior parte delle reazioni avverse sono state da lievi a moderate (Grado 1 o 2).
La reazione avversa più grave che può manifestarsi durante il trattamento con elotuzumab è l'infezione polmonare.
Le reazioni avverse più comuni (che si manifestano in > 10% dei pazienti) durante il trattamento con elotuzumab sono state: reazioni infusionali, diarrea, herpes zoster, nasofaringite, tosse, infezione polmonare, infezione delle vie respiratorie superiori, linfocitopenia e peso diminuito.
Tabella delle reazioni avverse
Le reazioni avverse segnalate in 554 pazienti con mieloma multiplo e trattati con elotuzumab in 6 studi clinici sono presentate nella Tabella 3.
Queste reazioni sono elencate secondo la classificazione per sistemi e organi e per frequenza. Le frequenze sono definite: molto comune (≥ 1/10); comune (≥ 1/100, < 1/10); non comune (≥ 1/1.000, < 1/100); rara (≥ 1/10.000, < 1/1.000); molto rara (< 1/10.000); non nota (la frequenza non può essere definita sulla base dei dati disponibili).
Tabella 3: Reazioni avverse in pazienti con mieloma multiplo trattati con Empliciti
|
Classificazione per
sistemi e organi
|
Reazioni avverse
|
Frequenza di tutti i
gradi
|
Frequenza di
Grado 3/4
|
|
Infezioni ed infestazioni
|
Herpes zostera
|
Molto comune
|
Comune
|
|
Nasofaringite
|
Molto comune
|
Nessun caso segnalato
|
|
|
Infezione polmonareb
|
Molto comune
|
Molto comune
|
|
|
Infezione delle vie
respiratorie superiori
|
Molto comune
|
Comune
|
|
|
Patologie del sistema
emolinfopoietico
|
Linfocitopeniac
|
Molto comune
|
Molto comune
|
|
Disturbi del sistema
immunitario
|
Reazione anafilattica
|
Non comune
|
Non comune
|
|
Ipersensibilità
|
Comune
|
Non comune
|
|
|
Disturbi psichiatrici
|
Umore alterato
|
Comune
|
Nessun caso segnalato
|
|
Patologie del sistema
nervoso
|
Cefalea
|
Molto comune
|
Non comune
|
|
Ipoestesia
|
Comune
|
Non comune
|
|
|
Patologie vascolari
|
Trombosi venosa
profonda
|
Comune
|
Comune
|
|
Patologie respiratorie,
toraciche e mediastiniche
|
Tossed
|
Molto comune
|
Non comune
|
|
Dolore orofaringeo
|
Comune
|
Nessun caso segnalato
|
|
|
Patologie
gastrointestinali
|
Diarrea
|
Molto comune
|
Comune
|
|
Patologie della cute e
del tessuto sottocutaneo
|
Sudorazione notturna
|
Comune
|
Nessun caso segnalato
|
|
Patologie sistemiche e
condizioni relative alla sede di somministrazione
|
Dolore toracico
|
Comune
|
Comune
|
|
Affaticamento
|
Molto comune
|
Comune
|
|
|
Piressia
|
Molto comune
|
Comune
|
|
|
Esami diagnostici
|
Peso diminuito
|
Molto comune
|
Non comune
|
|
Traumatismo,
avvelenamento e complicazioni da
procedura
|
Reazione da infusione
|
Comune
|
Comune
|
a Il termine herpes zoster è un raggruppamento dei seguenti termini: herpes zoster, herpes orale ed infezione da herpes virus.
b Il termine infezione polmonare è un raggruppamento dei seguenti termini: infezione polmonare, polmonite atipica,broncopolmonite, polmonite lobare, polmonite batterica, polmonite micotica, polmonite influenzale e polmonite pneumococcica.
c Il termine linfocitopenia comprende i seguenti termini: linfocitopenia e conta linfocitaria diminuita.
d Il termine tosse comprende i seguenti termini: tosse, tosse produttiva e sindrome delle vie aeree superiori con tosse.
La Tabella 4 riporta i tassi di reazioni avverse aggiustati per l'esposizione al trattamento (tutti i Gradi e Grado 3/4) nello Studio 1, uno studio clinico condotto in pazienti con mieloma multiplo che ha confrontato il trattamento con Empliciti in combinazione con lenalidomide e desametasone (N = 318) ed il trattamento con lenalidomide e desametasone (N = 317).
Tabella 4: Tassi di reazioni avverse aggiustati per l'esposizione in pazienti trattati con Empliciti rispetto ai pazienti trattati con lenalidomide e desametasone [comprendente i casi di eventi multipli in tutti i pazienti trattati]
|
|
Empliciti +
Lenalidomide e Desametasone
N = 318
|
Lenalidomide e Desametasone
N = 317
|
|||||||||
|
Tutti i gradi
|
Grado 3/4
|
Tutti i gradi
|
Grado 3/4
|
||||||||
|
Reazione
avversa
|
Numero di eventi
|
Tasso (tasso
d'incidenza/100
anni-paziente)
|
Numero di eventi
|
Tasso (tasso
d'incidenza/100
anni-paziente)
|
Numero di eventi
|
Tasso (tasso
d'incidenza/100
anni-paziente)
|
Numero di eventi
|
Tasso (tasso
d'incidenza/100
anni-paziente)
|
|||
|
Diarrea
|
303
|
59,2
|
19
|
3,7
|
206
|
49,3
|
13
|
3,1
|
|||
|
Piressia
|
220
|
43,0
|
8
|
1,6
|
116
|
27,7
|
10
|
2,4
|
|||
|
Affaticamento
|
205
|
40,0
|
33
|
6,4
|
145
|
34,7
|
26
|
6,2
|
|||
|
Tossea
|
170
|
33,2
|
1
|
0,2
|
85
|
20,3
|
-
|
-
|
|||
|
Nasofaringite
|
151
|
29,5
|
-
|
-
|
116
|
27,7
|
-
|
-
|
|||
|
Infezione
delle vie respiratorie superiori
|
129
|
25,2
|
2
|
0,4
|
95
|
22,7
|
4
|
1,0
|
|||
|
Linfocitopeniab
|
90
|
17,6
|
65
|
12,7
|
57
|
13,6
|
31
|
7,4
|
|||
|
Cefalea
|
88
|
17,2
|
1
|
0,2
|
40
|
9,6
|
1
|
0,2
|
|||
|
Infezione
polmonarec
|
80
|
15,6
|
54
|
10,5
|
54
|
12,9
|
34
|
8,1
|
|||
|
Herpes
zosterd
|
51
|
10,0
|
5
|
1,0
|
24
|
5,7
|
3
|
0,7
|
|||
|
Dolore
orofaringeo
|
45
|
8,8
|
-
|
-
|
17
|
4,1
|
-
|
-
|
|||
|
Peso
diminuito
|
44
|
8,6
|
4
|
0,8
|
20
|
4,8
|
-
|
-
|
|||
|
Sudorazione notturna
|
31
|
6,1
|
-
|
-
|
12
|
2,9
|
-
|
-
|
|||
|
Dolore
toracico
|
29
|
5,7
|
2
|
0,4
|
12
|
2,9
|
1
|
0,2
|
|||
|
Trombosi
venosa profonda
|
26
|
5,1
|
18
|
3,5
|
12
|
2,9
|
7
|
1,7
|
|||
|
Ipoestesia
|
25
|
4,9
|
1
|
0,2
|
12
|
2,9
|
-
|
-
|
|||
|
Umore alterato
|
23
|
4,5
|
-
|
-
|
8
|
1,9
|
-
|
-
|
|||
|
Ipersensibilità
|
10
|
2,0
|
-
|
-
|
4
|
1,0
|
1
|
0,2
|
|||
a Il termine tosse comprende i seguenti termini: tosse, tosse produttiva e sindrome delle vie aeree superiori con tosse.
b Il termine linfocitopenia comprende i seguenti termini: linfocitopenia e conta linfocitaria diminuita.
c Il termine infezione polmonare è un raggruppamento dei seguenti termini: infezione polmonare, polmonite atipica, broncopolmonite, polmonite lobare, polmonite batterica, polmonite micotica, polmonite influenzale e polmonite pneumococcica.
d Il termine herpes zoster è un raggruppamento dei seguenti termini: herpes zoster, herpes orale ed infezione da herpes virus.
Descrizione di reazioni avverse selezionate
Reazioni infusionali
In uno studio clinico condotto in pazienti con mieloma multiplo (Studio 1), una reazione infusionale è stata segnalata in circa il 10% dei pazienti premedicati trattati con Empliciti in combinazione con lenalidomide e desametasone (N = 318) (vedere paragrafo 4.4). L'incidenza delle reazioni infusionali da lievi a moderate è stata > 50% nei pazienti che non erano stati sottoposti a premedicazione. Tutte le reazioni infusionali segnalate sono state di Grado ≤ 3. Le reazioni infusionali di Grado 3 si sono manifestate nell'1% dei pazienti. Tra i sintomi più comuni di una reazione infusionale erano compresi febbre, brividi ed ipertensione. Nel cinque percento (5%) dei pazienti è stata necessaria l'interruzione della somministrazione di Empliciti per una mediana di 25 minuti a causa della reazione all'infusione e l'1% dei pazienti ha sospeso la terapia a causa di reazioni all'infusione. Dei pazienti che hanno manifestato una reazione infusionale, il 70% (23/33) ha manifestato la reazione durante la somministrazione della prima dose.
Infezioni
L'incidenza delle infezioni, inclusa l'infezione polmonare, è stata più elevata nei pazienti trattati con Empliciti rispetto ai controlli (vedere paragrafo 4.4). In uno studio clinico condotto in pazienti con mieloma multiplo (Studio 1), sono state riportate infezioni nell'81,4% dei pazienti del gruppo di trattamento con Empliciti in combinazione con lenalidomide e desametasone (N = 318) e nel 74,4% dei pazienti del gruppo di trattamento con lenalidomide e desametasone (N = 317). Le infezioni di Grado 3-4 sono state rilevate rispettivamente nel 28% dei pazienti trattati con Empliciti in combinazione con lenalidomide e desametasone e nel 24,3% dei pazienti trattati con lenalidomide e desametasone. Le infezioni fatali sono state infrequenti e sono state riportate nel 2,5% dei pazienti trattati con Empliciti in combinazione con lenalidomide e desametasone e nel 2,2% dei pazienti trattati con lenalidomide e desametasone. L'incidenza di infezione polmonare è stata più elevata nel braccio di trattamento con Empliciti in combinazione con lenalidomide e desametasone rispetto al braccio di trattamento con lenalidomide e desametasone, essendo stata riportata rispettivamente nel 15,1% vs. 11,7% dei pazienti, con esito fatale rispettivamente nello 0,6% e 0% dei casi.
Secondi tumori primari (SPM)
L'incidenza di SPM è stata più elevata nei pazienti trattati con Empliciti rispetto ai controlli (vedere paragrafo 4.4). In uno studio clinico condotto in pazienti con mieloma multiplo (Studio 1), SPM invasivi sono stati osservati nel 6,9% dei pazienti trattati con Empliciti in combinazione con lenalidomide e desametasone (N = 318) e nel 4,1% dei pazienti trattati con lenalidomide e desametasone (N = 317). È noto che l'esposizione alla lenalidomide è associata alla comparsa di secondi tumori primari e tale esposizione è risultata prolungata nei pazienti trattati con Empliciti in combinazione con lenalidomide e desametasone rispetto a pazienti trattati con lenalidomide e desametasone. Il tasso d'incidenza delle neoplasie ematologiche è risultato lo stesso nei due bracci di trattamento (1,6%). I tumori solidi sono stati riportati rispettivamente nel 2,5% dei pazienti trattati con Empliciti in combinazione con lenalidomide e desametasone e nell'1,9% dei pazienti trattati con lenalidomide e desametasone. Il carcinoma cutaneo di tipo non melanoma è stato riportato rispettivamente nel 3,1% dei pazienti trattati con Empliciti in combinazione con lenalidomide e desametasone e nell'1,6% dei pazienti trattati con lenalidomide e desametasone.
Trombosi venosa profonda
In uno studio clinico condotto in pazienti con mieloma multiplo (Studio 1), trombosi venose profonde sono state segnalate nel 7,2% dei pazienti trattati con Empliciti in combinazione con lenalidomide e desametasone (N = 318) e nel 3,8% dei pazienti trattati con lenalidomide e desametasone (N = 317). Tra i pazienti trattati con aspirina, una trombosi venosa profonda è stata segnalata nel 4,1% dei pazienti trattati con Empliciti in combinazione con lenalidomide e desametasone (E-Ld) e nell'1,4% dei pazienti trattati con lenalidomide e desametasone (Ld). I tassi di trombosi venosa profonda osservati nei bracci di trattamento sono risultati simili nei pazienti in profilassi con eparina a basso peso molecolare (2,2% in entrambi i bracci di trattamento); nei pazienti che avevano ricevuto antagonisti della vitamina K i tassi sono stati dello 0% nei pazienti trattati con E-Ld e del 6,7% nei pazienti trattati con Ld.
Immunogenicità
Come per tutte le proteine ad uso terapeutico, esiste un potenziale di risposta immunitaria ad Empliciti.
Dei 390 pazienti che sono stati trattati con Empliciti in quattro studi clinici e valutabili per la presenza di anticorpi anti-farmaco, 72 pazienti (18,5%) sono risultati positivi al test di elettrochemiluminescenza (ECL), per anticorpi anti-farmaco sviluppati in corso di trattamento.
Anticorpi neutralizzanti sono stati rilevati in 19 dei 299 pazienti dello Studio 1. Nella maggioranza dei pazienti, l'immunogenicità si è manifestata precocemente nel trattamento, è stata transitoria e si è risolta in 2-4 mesi. Sulla base di analisi di farmacocinetica di popolazione e esposizione-risposta, non sono emerse chiare evidenze di un nesso causale tra lo sviluppo di anticorpi anti-farmaco e alterazioni del profilo farmacocinetico, di efficacia o tossicologico.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all'indirizzo www.agenziafarmaco.gov.it/it/responsabili.
Sovradosaggio
Cosa fare se avete preso una dose eccessiva di Empliciti
In un paziente è stato riferito un sovradosaggio con 23,3 mg/kg di Elotuzumab in combinazione con lenalidomide e desametasone. Il paziente era asintomatico, non ha richiesto alcun trattamento per il sovradosaggio ed ha potuto continuare la terapia con elotuzumab.
Negli studi clinici sono stati valutati circa 78 pazienti trattati con elotuzumab alla dose di 20 mg/kg senza apparenti effetti tossici.
In caso di sovradosaggio, i pazienti devono essere sottoposti a stretto monitoraggio per individuare segni o sintomi di reazioni avverse e deve essere istituito un appropriato trattamento sintomatico.
Scadenza
Flaconcino chiuso
3 anni.
Dopo la ricostituzione e la diluizione
La soluzione ricostituita deve essere trasferita immediatamente dal flaconcino alla sacca per infusione.
La stabilità chimica e fisica in uso della soluzione ricostituita e diluita è stata dimostrata per 24 ore a 2°C - 8°C ed al riparo dalla luce.
Da un punto di vista microbiologico, la soluzione per infusione deve essere utilizzata immediatamente. Se non viene utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell'uso sono sotto la responsabilità dell'utilizzatore e, solitamente, non devono superare le 24 ore a 2°C - 8°C, al riparo dalla luce. Non congelare la soluzione ricostituita o diluita. La soluzione per infusione può essere conservata per un massimo di 8 ore delle 24 ore totali a 20°C − 25°C ed in normali condizioni di luce ambientale. Questo periodo di 8 ore deve includere il periodo di somministrazione del prodotto.
Conservazione
Conservare in frigorifero (2°C - 8°C). Non congelare.
Conservare nella confezione originale per proteggere il medicinale dalla luce.
Per le condizioni di conservazione dopo la ricostituzione o la diluizione del medicinale, vedere paragrafo 6.3.
Foglietto Illustrativo
Fonti Ufficiali
© 2022 EDRA S.p.A. - P.iva 08056040960
DPO - dpo@lswr.it