Dabigatran EG Stada - Capsula
Cos'è Dabigatran EG Stada - Capsula?
Dabigatran EG Stada - Capsula può essere prescritto con Ricetta RR - medicinali soggetti a prescrizione medica.
Confezioni
Informazioni commerciali sulla prescrizione
Ricetta: RR - medicinali soggetti a prescrizione medica
Classe: A
Principio attivo: Dabigatran Etexilato
Gruppo terapeutico: Anticoagulanti orali diretti
ATC: B01AE07 - Dabigatran etexilato
Forma farmaceutica: capsula
Se sei un professionista, potrai trovare le schede tecniche complete e molto altro nell'area riservata di Codifa.it
Indicazioni
Posologia
|
|
Inizio del trattamento il giorno dell'intervento chirurgico 1-4 ore dopo la conclusione dell'intervento chirurgico
|
Inizio della dose di mantenimento il primo giorno successivo all'intervento chirurgico
|
Durata della terapia con la dose di mantenimento
|
|
Pazienti sottoposti a chirurgia sostitutiva elettiva del ginocchio
|
capsula singola di Dabigatran Etexilato EG STADA da 110 mg
|
220 mg di dabigatran etexilato una volta al giorno assunti come 2 capsule da 110 mg
|
10 giorni
|
|
Pazienti sottoposti a chirurgia sostitutiva elettiva dell'anca
|
28-35 giorni
|
||
|
Riduzione raccomandata della dose
|
|
|
|
|
Pazienti con compromissione renale moderata (clearance della creatinina, CLCr 30-50 mL/min)
|
capsula singola di Dabigatran Etexilato EG STADA da 75 mg
|
150 mg di Dabigatran Etexilato EG STADA
una volta al giorno assunti come 2 capsule da 75 mg
|
10 giorni (chirurgia sostitutiva del ginocchio) o 28-35 giorni (chirurgia sostitutiva dell'anca)
|
|
Pazienti che ricevono contestualmente verapamil*, amiodarone, chinidina
|
|||
|
Pazienti di età pari o superiore a 75 anni
|
- La funzionalità renale deve essere valutata calcolando la clearance della creatinina (CLCr) prima dell'inizio del trattamento con Dabigatran Etexilato EG STADA per escludere i pazienti con compromissione renale severa (cioè CLCr < 30 mL/min) (vedere i paragrafi 4.3, 4.4 e 5.2).
- La funzionalità renale deve essere valutata anche quando si sospetti una riduzione della funzionalità renale durante il trattamento (ad esempio ipovolemia, disidratazione ed in caso di uso concomitante di alcuni medicinali).
Switch
| Dose raccomandata | |
|
Prevenzione di ictus ed embolia sistemica in pazienti adulti con FANV con uno o più fattori di rischio
|
Dabigatran Etexilato EG STADA 300 mg assunti come una capsula da 150 mg due volte al giorno
|
|
Trattamento della TVP e dell'EP e prevenzione delle recidive di TVP e EP negli adulti (TVP/EP)
|
Dabigatran Etexilato EG STADA 300 mg assunti come una capsula da 150 mg due volte al giorno, successivamente al trattamento con un anticoagulante parenterale somministrato per almeno 5 giorni
|
|
Raccomandazione di riduzione della dose
|
|
|
Pazienti di età ≥ 80 anni
|
200 mg al giorno di Dabigatran Etexilato EG STADA assunto, come una capsula da 110 mg due volte al giorno
|
|
Pazienti in trattamento concomitante con verapamil
|
|
|
Riduzione della dose da prendere in considerazione
|
|
|
Pazienti di età compresa tra 75 e 80 anni
|
la dose giornaliera di Dabigatran Etexilato EG STADA di 300 mg o di 220 mg deve essere stabilita su base individuale valutando il rischio tromboembolico e il rischio di sanguinamento
|
|
Pazienti con compromissione renale moderata (CLCr 30-50 mL/min)
|
|
|
Pazienti con gastrite, esofagite o reflusso gastroesofageo
|
|
|
Altri pazienti ad aumentato rischio di sanguinamento
|
- La funzione renale deve essere valutata calcolando la clearance della creatinina (CLCr) prima dell'inizio del trattamento con Dabigatran Etexilato EG STADA per escludere i pazienti con compromissione renale severa (cioè CLCr < 30 mL/min) (vedere i paragrafi 4.3, 4.4 e 5.2).
- La funzione renale deve essere valutata anche quando si sospetti una riduzione della funzione renale durante il trattamento (ad esempio ipovolemia, disidratazione ed in caso di uso concomitante di alcuni medicinali).
- La funzione renale deve essere valutata durante il trattamento con Dabigatran Etexilato EG STADA almeno una volta all'anno o più frequentemente come richiesto in certe situazioni cliniche quando si sospetti una riduzione od un peggioramento della funzione renale (ad esempio ipovolemia, disidratazione ed in caso di uso concomitante di alcuni medicinali).
Durata del trattamento
|
Indicazione
|
Durata del trattamento
|
|
Prevenzione di ictus in pazienti con fibrillazione atriale
|
La terapia deve essere proseguita a lungo termine.
|
|
TVP/EP
|
La durata della terapia deve essere stabilita dopo un'attenta valutazione del beneficio della terapia rispetto al rischio di sanguinamento (vedere paragrafo 4.4).
La scelta della terapia di breve durata (almeno 3 mesi) si deve basare su fattori di rischio transitorio (ad esempio recente intervento, trauma, immobilizzazione) e quelle di più lunga durata su fattori di rischio permanente o TVP idiopatica o EP.
|
- CLCr ≥ 50 mL/min, si deve iniziare l'AVK 3 giorni prima della sospensione di dabigatran etexilato
- CLCr ≥ 30 - < 50 mL/min, si deve iniziare l'AVK 2 giorni prima della sospensione di dabigatran etexilato
Cardioversione (prevenzione di ictus in pazienti con fibrillazione atriale)
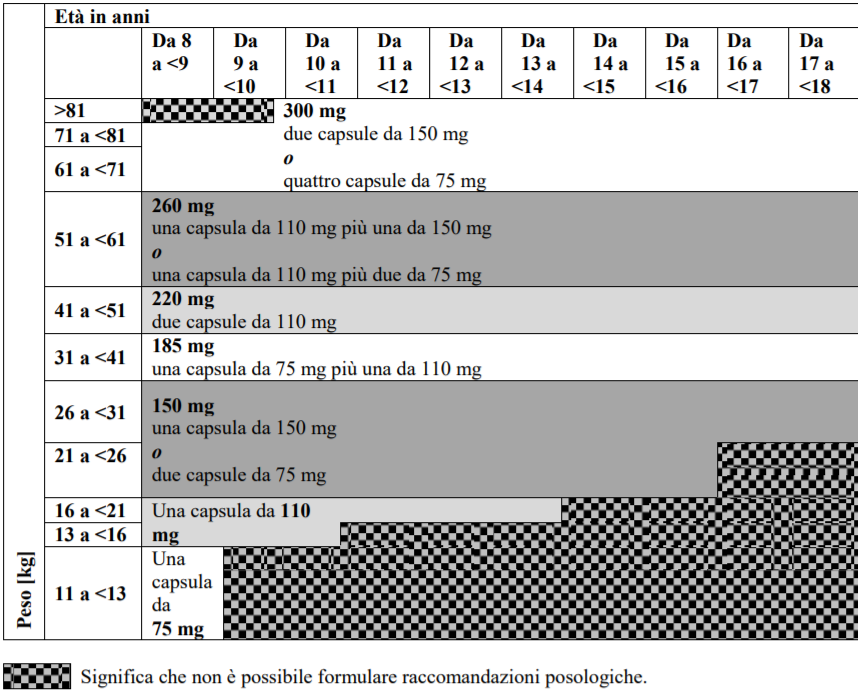
- Dabigatran Etexilato granulato rivestito che può essere utilizzato nei bambini di età inferiore a 12 anni non appena il bambino è in grado di ingerire cibi morbidi.
- Dabigatran Etexilato polvere e solvente per soluzione orale devono essere usati solo nei bambini di età inferiore a 1 anno.
Controindicazioni
- Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
- Compromissione renale severa (CLCr < 30 mL/min) nei pazienti adulti.
- eGFR < 50 mL/min/1,73 m2 nei pazienti pediatrici.
- Sanguinamento attivo clinicamente significativo.
- Lesioni o condizioni, se considerate un fattore di rischio significativo di sanguinamento maggiore.
Possono includere ulcera gastrointestinale in corso o recente, presenza di neoplasie maligne ad elevato rischio di sanguinamento, recente lesione cerebrale o spinale, recente intervento chirurgico a livello cerebrale, spinale od oftalmico, recente emorragia intracranica, varici esofagee accertate o sospette, malformazioni arterovenose, aneurismi vascolari o anomalie vascolari maggiori intraspinali o intracerebrali. - Trattamento concomitante con ogni altro anticoagulante come eparina non frazionata (ENF), eparine a basso peso molecolare (enoxaparina, dalteparina ecc.), derivati dell'eparina (fondaparinux ecc.), anticoagulanti orali (warfarin, rivaroxaban, apixaban ecc.) fatta eccezione per specifiche circostanze.
Tra queste il cambio di terapia anticoagulante (vedere paragrafo 4.2) quando l'ENF è somministrata alle dosi necessarie per mantenere pervio un catetere centrale venoso o arterioso oppure durante l'ablazione transcatetere per fibrillazione atriale (vedere paragrafo 4.5). - Compromissione epatica o malattia epatica che possa avere un qualsiasi impatto sulla sopravvivenza.
- Trattamento concomitante con i seguenti forti inibitori della P-gp: ketoconazolo ad uso sistemico, ciclosporina, itraconazolo, dronedarone e l'associazione a dose fissa glecaprevir/pibrentasvir (vedere paragrafo 4.5).
- Protesi valvolari cardiache che richiedano trattamento anticoagulante (vedere paragrafo 5.1).
Avvertenze speciali e precauzioni di impiego
|
|
Fattore di rischio
|
|
Fattori farmacodinamici e cinetici
|
Età ≥ 75 anni
|
|
Fattori che aumentano i livelli plasmatici di dabigatran
|
Maggiori:
· Compromissione renale moderata in pazienti adulti (CLCr 30-50 mL/min)
· Forti inibitori della P-gp (vedere paragrafi 4.3 e 4.5)
· Co-somministrazione di inibitori della P-gp da deboli a moderati (ad es. amiodarone, verapamil, chinidina e ticagrelor; vedere paragrafo 4.5)
Minori:
· Basso peso corporeo (< 50 kg) in pazienti adulti
|
|
Interazioni farmacodinamiche (vedere paragrafo 4.5)
|
· ASA e altri inibitori della aggregazione piastrinica come clopidogrel
· FANS
· SSRI o SNRI
· Altri medicinali che possono alterare l'emostasi
|
|
Patologie / procedure con rischi emorragici speciali
|
· Disturbi della coagulazione congeniti o acquisiti
· Trombocitopenia o disturbi della funzionalità delle piastrine
· Biopsia recente, trauma maggiore
· Endocardite batterica
· Esofagite, gastrite o reflusso gastroesofageo
|
|
Test (valore di valle)
|
Indicazione
|
|
|
|
Prevenzione primaria di TEV in chirurgia ortopedica
|
Prevenzione di ictus in pazienti con fibrillazione atriale e TVP/EP
|
|
dTT [ng/mL]
|
> 67
|
> 200
|
|
ECT [x-volte maggiore del limite superiore della norma]
|
Non ci sono dati
|
> 3
|
|
aPTT [x-volte maggiore del limite superiore della norma]
|
> 1,3
|
> 2
|
|
INR
|
Non deve essere effettuato
|
Non deve essere effettuato
|
|
Funzionalità renale (CLCr in mL/min)
|
Emivita stimata (ore)
|
L'assunzione di Dabigatran Etexilato EG STADA deve essere interrotta prima della chirurgia elettiva
|
|
|
Elevato rischio di sanguinamento o chirurgia maggiore
|
Rischio standard
|
||
|
≥ 80
|
~ 13
|
2 giorni prima
|
24 ore prima
|
|
≥ 50 - < 80
|
~ 15
|
2-3 giorni prima
|
1-2 giorni prima
|
|
≥ 30 - < 50
|
~ 18
|
4 giorni prima
|
2-3 giorni prima (> 48 ore)
|
|
Funzionalità renale (eGFR in mL/min/1,73 m2)
|
Sospendere dabigatran prima della chirurgia elettiva
|
|
> 80
|
24 ore prima
|
|
50 – 80
|
2 giorni prima
|
|
< 50
|
Questi pazienti non sono stati studiati (vedere paragrafo 4.3).
|
Interazioni con altri medicinali e altre forme di interazione
|
Inibitori della P-gp
|
|
|
Uso concomitante controindicato (vedere paragrafo 4.3)
|
|
|
Ketoconazolo
|
Il ketoconazolo ha aumentato i valori totali di AUC0-∞ e Cmax di dabigatran di 2,38 volte e 2,35 volte, rispettivamente dopo una dose orale singola di 400 mg, di 2,53 volte e 2,49 volte rispettivamente, dopo dosi orali multiple di 400 mg una volta al giorno.
|
|
Dronedarone
|
Quando dabigatran etexilato e dronedarone erano somministrati contestualmente i valori totali dell'AUC0-∞ e della Cmax di dabigatran aumentavano rispettivamente di circa 2,4 volte e 2,3 volte, dopo dosi multiple di 400 mg di dronedarone bid, e rispettivamente di circa 2,1 volte e 1,9 volte dopo una dose singola di 400 mg.
|
|
Itraconazolo, ciclosporina
|
Sulla base dei risultati in vitro ci si può aspettare un effetto simile a quello di ketoconazolo.
|
|
Glecaprevir /pibrentasvir
|
L'uso concomitante di dabigatran etexilato con l'associazione a dose fissa degli inibitori della P-gp glecaprevir/pibrentasvir ha dimostrato di aumentare l'esposizione a dabigatran e può aumentare il rischio di sanguinamento.
|
|
Uso concomitante non raccomandato
|
|
|
Tacrolimus
|
In vitro tacrolimus ha dimostrato avere un effetto inibitorio sulla P-gp simile a quello osservato per itraconazolo e ciclosporina. Dabigatran etexilato non è stato studiato clinicamente in associazione a tacrolimus. Tuttavia, i limitati dati clinici disponibili con un altro substrato della P-gp (everolimus) suggeriscono che l'inibizione della P-gp con tacrolimus sia più debole di quella osservata con potenti inibitori della P-gp.
|
|
Uso concomitante con cautela (vedere paragrafi 4.2 e 4.4)
|
|
|
Verapamil
|
Quando dabigatran etexilato (150 mg) è stato co-somministrato con verapamil per via orale, la Cmax e l'AUC di dabigatran aumentavano, ma le dimensioni di questo cambiamento variavano in funzione del tempo di somministrazione e della formulazione di verapamil (vedere paragrafi 4.2 e 4.4).
L'aumento massimo di esposizione a dabigatran è stato osservato con la prima dose di una formulazione a rilascio immediato di verapamil, somministrata un'ora prima dell'assunzione di dabigatran etexilato (aumento della Cmax di circa 2,8 volte e dell'AUC di circa 2,5 volte). L'effetto era progressivamente diminuito con la somministrazione di una formulazione a rilascio prolungato (aumento della Cmax di circa 1,9 volte e dell'AUC di circa 1,7 volte) o con la somministrazione di dosi multiple di verapamil (aumento della Cmax di circa 1,6 volte e aumento dell'AUC di circa 1,5 volte).
Non è stata osservata un'interazione significativa quando verapamil è stato somministrato 2 ore dopo l'assunzione di dabigatran etexilato (aumento della Cmax di circa 1,1 volte e aumento dell'AUC di circa 1,2 volte). Ciò è spiegato dall'assorbimento completo di dabigatran dopo 2 ore.
|
|
Amiodarone
|
Quando dabigatran etexilato è stato co- somministrato con una dose singola orale di 600 mg di amiodarone, la quantità e la velocità di assorbimento di amiodarone e del suo metabolita attivo DEA sono rimaste essenzialmente immodificate.
L'AUC e la Cmax di dabigatran sono aumentate di circa 1,6 volte e 1,5 volte rispettivamente. Considerando la lunga emivita di amiodarone, la potenziale interazione può durare per settimane dopo la sospensione di amiodarone (vedere paragrafi 4.2 e 4.4).
|
|
Chinidina
|
La chinidina è stata somministrata a dosi di 200 mg ogni 2 ore fino ad una dose totale di
1.000 mg. Dabigatran etexilato è stato somministrato due volte al giorno per 3 giorni consecutivi, al terzo giorno con o senza chinidina. L'AUCτ,ss e la Cmax,ss di dabigatran erano aumentate rispettivamente in media di 1,53 volte e di 1,56 volte, con la somministrazione concomitante di chinidina (vedere paragrafi 4.2 e 4.4).
|
|
Claritromicina
|
Quando la claritromicina (500 mg due volte al giorno) è stata somministrata in associazione a dabigatran etexilato in volontari sani, è stato osservato un aumento dell'AUC di circa 1,19 volte e della Cmax di circa 1,15 volte.
|
|
Ticagrelor
|
Quando una dose singola di 75 mg di dabigatran etexilato è stata somministrata contemporaneamente a una dose iniziale di 180 mg di ticagrelor, l'AUC e la Cmax di dabigatran sono aumentate rispettivamente di 1,73 e di 1,95 volte. Dopo somministrazione multipla di 90 mg di ticagrelor bid l'aumento dell'esposizione a dabigatran è di 1,56 e di 1,46 volte rispettivamente per la Cmax e l'AUC.
La somministrazione concomitante di una dose iniziale di 180 mg di ticagrelor e di 110 mg di dabigatran etexilato (allo stato stazionario) aumentava la AUCτ,ss e la Cmax,ss di dabigatran rispettivamente di 1,49 volte e di 1,65 volte, rispetto alla somministrazione del solo dabigatran etexilato. Quando una dose iniziale di 180 mg di ticagrelor veniva somministrata 2 ore dopo la somministrazione di dabigatran etexilato 110 mg (allo stato stazionario), l'aumento della AUCτ,ss e della Cmax,ss di dabigatran si riduceva rispettivamente a 1,27 volte ed a 1,23 volte, rispetto alla somministrazione del solo dabigatran etexilato. Questa somministrazione scaglionata è quella raccomandata per cominciare ticagrelor con una dose iniziale.
La somministrazione concomitante di 90 mg di ticagrelor bid (dose di mantenimento) con 110 mg di dabigatran etexilato aumentava la AUCτ,ss e la Cmax,ss aggiustate di dabigatran rispettivamente di 1,26 volte e di 1,29 volte, rispetto alla somministrazione del solo dabigatran etexilato.
|
|
Posaconazolo
|
Anche posaconazolo in parte inibisce la P-gp, ma non è stato studiato clinicamente. La co- somministrazione di dabigatran etexilato e posaconazolo deve essere effettuata con cautela.
|
|
Induttori della P-gp
|
|
|
Uso concomitante da evitare
|
|
|
es. rifampicina, erba di san Giovanni (Hypericum perforatum),
carbamazepina o fenitoina
|
È atteso che la somministrazione concomitante riduca le concentrazioni di dabigatran.
La pre-somministrazione dell'induttore rifampicina ad una dose di 600 mg una volta al giorno per 7 giorni ha ridotto il picco totale di dabigatran e l'esposizione totale rispettivamente del 65,5% e del 67%. L'effetto induttore era diminuito determinando un'esposizione a dabigatran vicina al valore di riferimento entro il settimo giorno successivo alla sospensione del trattamento con rifampicina.
Dopo ulteriori 7 giorni non sono stati osservati incrementi della biodisponibilità.
|
|
Inibitori della proteasi come ritonavir
|
|
|
Uso concomitante non raccomandato
|
|
|
es. ritonavir e le sue associazioni con altri inibitori della proteasi
|
Questi influiscono sulla P-gp (sia come inibitori che come induttori). Poiché non sono stati studiati, l'uso concomitante con dabigatran etexilato non è raccomandato.
|
|
Substrato della P-gp
|
|
|
Digossina
|
In uno studio condotto su 24 soggetti sani, quando dabigatran etexilato è stato somministrato in associazione a digossina non sono state osservate modifiche dell'esposizione a digossina né alterazioni cliniche significative dell'esposizione a dabigatran.
|
|
FANS
|
I FANS somministrati come analgesici a breve durata d'azione hanno mostrato di non essere associati ad un aumentato rischio di sanguinamento quando somministrati in concomitanza a dabigatran etexilato. Con l'uso cronico nello studio RE-LY, i FANS aumentavano il rischio di sanguinamento di circa il 50% sia con dabigatran etexilato che con warfarin.
|
|
Clopidogrel
|
In volontari sani, giovani, di sesso maschile la somministrazione concomitante di dabigatran etexilato e clopidogrel non determinava un ulteriore prolungamento dei tempi di sanguinamento capillare rispetto a clopidogrel in monoterapia. Inoltre, l'AUCτ,ss e la Cmax,ss e le misure di coagulazione per l'effetto di dabigatran o l'inibizione dell'aggregazione piastrinica come misura dell'effetto di clopidogrel sono rimaste essenzialmente immodificate confrontando il trattamento combinato e i rispettivi mono-trattamenti. Con una dose di carico di 300 mg o 600 mg di clopidogrel, l'AUCτ,ss e la Cmax,ss di dabigatran erano aumentate di circa il 30-40% (vedere paragrafo 4.4).
|
|
ASA
|
La co-somministrazione di ASA e di 150 mg di dabigatran etexilato due volte al giorno può aumentare il rischio di ogni tipo di sanguinamento dal 12% al 18% e 24% con 81
mg e 325 mg di ASA rispettivamente (vedere paragrafo 4.4).
|
|
EBPM
|
L'uso concomitante di EBPM quale enoxaparina e dabigatran etexilato non è stato valutato in modo specifico. Dopo il passaggio da un trattamento di 3 giorni con 40 mg di enoxaparina somministrati una volta al giorno per via s.c., 24 ore dopo la somministrazione dell'ultima dose di enoxaparina l'esposizione a dabigatran era lievemente inferiore rispetto a quella successiva alla somministrazione di dabigatran etexilato da solo (dose singola da 220 mg). È stata osservata una maggiore attività anti-FXa/FIIa dopo la somministrazione di dabigatran etexilato preceduta dal pre- trattamento con enoxaparina rispetto al trattamento con dabigatran etexilato da solo. Si ritiene che ciò sia dovuto ad un effetto trainante del trattamento con enoxaparina ed è considerato non clinicamente rilevante. I risultati di altri test di attività anticoagulante correlata a dabigatran non erano modificati in modo significativo dal pre-trattamento con enoxaparina.
|
|
Inibitori selettivi della ricaptazione della serotonina (SSRI) o inibitori selettivi della ricaptazione della serotonina e della norepinefrina (SNRI)
|
|
|
SSRIs, SNRIs
|
Gli SSRI e gli SNRI hanno incrementato il rischio di sanguinamento in tutti i gruppi di trattamento dello studio RE-LY.
|
|
Sostanze che influenzano il pH gastrico
|
|
|
Pantoprazolo
|
Quando Dabigatran Etexilato EG STADA è stato somministrato in associazione a pantoprazolo, è stata osservata una riduzione di circa il 30% dell'AUC di dabigatran. Pantoprazolo ed altri inibitori della pompa protonica (PPI) sono stati co- somministrati con Dabigatran Etexilato EG STADA negli studi clinici e il trattamento concomitante con PPI non ha mostrato una riduzione dell'efficacia di Dabigatran Etexilato EG STADA.
|
|
Ranitidina
|
La somministrazione di ranitidina con dabigatran etexilato non ha effetti clinicamente rilevanti sull'assorbimento di Dabigatran Etexilato EG STADA.
|
Popolazione pediatrica
Sono stati effettuati studi d'interazione solo negli adulti.
Interazioni riportate su letteratura scientifica internazionale
Prima di prendere "Dabigatran EG Stada - Capsula" insieme ad altri farmaci come “Paxlovid”, etc.., chiedi al tuo al tuo medico o farmacista di fiducia di verificare che sia sicuro e non dannoso per la tua salute ...
Fertilità, gravidanza e allattamento
Effetti sulla capacità di guidare veicoli e sull'uso di macchinari
Effetti indesiderati
|
|
Frequenza
|
||
|
SOC / Termine preferito
|
Prevenzione primaria di TEV dopo chirurgia sostitutiva dell'anca o del ginocchio
|
Prevenzione di ictus ed embolia sistemica in pazienti con fibrillazione atriale
|
Trattamento di TVP/EP e
prevenzione di TVP/EP
|
|
Patologie del sistema emolinfopoietico
|
|
||
|
Anemia
|
Non comune
|
Comune
|
Non comune
|
|
Diminuzione dei valori dell'emoglobina
|
Comune
|
Non comune
|
Non nota
|
|
Trombocitopenia
|
Raro
|
Non comune
|
Raro
|
|
Diminuzione dei valori
dell'ematocrito
|
Non comune
|
Raro
|
Non nota
|
|
Neutropenia
|
Non nota
|
Non nota
|
Non nota
|
|
Agranulocitosi
|
Non nota
|
Non nota
|
Non nota
|
|
Disturbi del sistema immunitario
|
|
||
|
Ipersensibilità al medicinale
|
Non comune
|
Non comune
|
Non comune
|
|
Rash cutaneo
|
Raro
|
Non comune
|
Non comune
|
|
Prurito
|
Raro
|
Non comune
|
Non comune
|
|
Reazione anafilattica
|
Raro
|
Raro
|
Raro
|
|
Angioedema
|
Raro
|
Raro
|
Raro
|
|
Orticaria
|
Raro
|
Raro
|
Raro
|
|
Broncospasmo
|
Non nota
|
Non nota
|
Non nota
|
|
Patologie del sistema nervoso
|
|
||
|
Emorragia intracranica
|
Raro
|
Non comune
|
Raro
|
|
Patologie vascolari
|
|
||
|
Ematoma
|
Non comune
|
Non comune
|
Non comune
|
|
Emorragie
|
Raro
|
Non comune
|
Non comune
|
|
Emorragie dalle ferite
|
Non comune
|
-
|
-
|
|
Patologie respiratorie, toraciche e mediastiniche
|
|
||
|
Epistassi
|
Non comune
|
Comune
|
Comune
|
|
Emottisi
|
Raro
|
Non comune
|
Non comune
|
|
Patologie gastrointestinali
|
|
||
|
Emorragia gastrointestinale
|
Non comune
|
Comune
|
Comune
|
|
Dolore addominale
|
Raro
|
Comune
|
Non comune
|
|
Diarrea
|
Non comune
|
Comune
|
Non comune
|
|
Dispepsia
|
Raro
|
Comune
|
Comune
|
|
Nausea
|
Non comune
|
Comune
|
Non comune
|
|
Emorragia rettale
|
Non comune
|
Non comune
|
Comune
|
|
Emorragia emorroidale
|
Non comune
|
Non comune
|
Non comune
|
|
Ulcera gastrointestinale,
inclusa ulcera esofagea
|
Raro
|
Non comune
|
Non comune
|
|
Gastroesofagite
|
Raro
|
Non comune
|
Non comune
|
|
Malattia da reflusso
gastroesofageo
|
Raro
|
Non comune
|
Non comune
|
|
Vomito
|
Non comune
|
Non comune
|
Non comune
|
|
Disfagia
|
Raro
|
Non comune
|
Raro
|
|
Patologie epatobiliari
|
|
||
|
Funzionalità epatica alterata
/ Test di funzionalità epatica alterati
|
Comune
|
Non comune
|
Non comune
|
|
Aumento dell'alanina
aminotransferasi
|
Non comune
|
Non comune
|
Non comune
|
|
Aumento dell'aspartato
aminotransferasi
|
Non comune
|
Non comune
|
Non comune
|
|
Aumento degli enzimi epatici
|
Non comune
|
Raro
|
Non comune
|
|
Iperbilirubinemia
|
Non comune
|
Raro
|
Non nota
|
|
Patologie della cute e del tessuto sottocutaneo
|
|
||
|
Emorragia cutanea
|
Non comune
|
Comune
|
Comune
|
|
Alopecia
|
Non nota
|
Non nota
|
Non nota
|
|
Patologie del sistema muscoloscheletrico e del tessuto connettivo
|
|
||
|
Emartrosi
|
Non comune
|
Raro
|
Non comune
|
|
Patologie renali e urinarie
|
|
||
|
Emorragia
genitourinaria, inclusa ematuria
|
Non comune
|
Comune
|
Comune
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione
|
|
||
|
Emorragia al sito di iniezione
|
Raro
|
Raro
|
Raro
|
|
Emorragia al sito di inserzione
|
Raro
|
Raro
|
Raro
|
|
Sanguinamento
|
Raro
|
-
|
-
|
|
Traumatismo, avvelenamento e complicazioni da procedura
|
|
||
|
Emorragia traumatica
|
Non comune
|
Raro
|
Non comune
|
|
Emorragia al sito di incisione
|
Raro
|
Raro
|
Raro
|
|
Ematoma post-procedurale
|
Non comune
|
-
|
-
|
|
Emorragia post-
procedurale
|
Non comune
|
-
|
-
|
|
Anemia post-operatoria
|
Raro
|
-
|
-
|
|
Suppurazione postprocedurale
|
Non comune
|
-
|
-
|
|
Secrezione dalle ferite
|
Non comune
|
-
|
-
|
|
Procedure mediche e chirurgiche
|
|
||
|
Drenaggio della ferita
|
Raro
|
-
|
-
|
|
Drenaggio post-procedurale
|
Raro
|
-
|
-
|
|
|
Dabigatran Etexilato EG STADA 150 mg
una volta al giorno N (%)
|
Dabigatran Etexilato EG STADA 220 mg
una volta al giorno N (%)
|
Enoxaparina N (%)
|
|
Trattati
|
1.866 (100,0)
|
1.825 (100,0)
|
1.848 (100,0)
|
|
Sanguinamento maggiore
|
24 (1,3)
|
33 (1,8)
|
27 (1,5)
|
|
Qualsiasi sanguinamento
|
258 (13,8)
|
251 (13,8)
|
247 (13,4)
|
|
|
Dabigatran Etexilato EG STADA 110 mg
due volte al giorno
|
Dabigatran Etexilato EG STADA 150 mg
due volte al giorno
|
Warfarin
|
|
Soggetti randomizzati
|
6.015
|
6.076
|
6.022
|
|
Sanguinamento maggiore
|
347 (2,92%)
|
409 (3,40%)
|
426 (3,61%)
|
|
Sanguinamento intracranico
|
27 (0,23%)
|
39 (0,32%)
|
91 (0,77%)
|
|
Sanguinamento GI
|
134 (1,13%)
|
192 (1,60%)
|
128 (1,09%)
|
|
Sanguinamento fatale
|
26 (0,22%)
|
30 (0,25%)
|
42 (0,36%)
|
|
Sanguinamento minore
|
1.566 (13,16%)
|
1.787 (14,85%)
|
1.931 (16,37%)
|
|
Qualsiasi sanguinamento
|
1.759 (14,78%)
|
1.997 (16,60%)
|
2.169 (18,39%)
|
I soggetti randomizzati a Dabigatran Etexilato EG STADA 110 mg due volte al giorno o 150 mg due volte al giorno erano esposti a un rischio significativamente minore di sanguinamenti pericolosi per la vita e sanguinamenti intracranici rispetto ai soggetti trattati con warfarin [p< 0,05]. Entrambi i dosaggi di Dabigatran Etexilato EG STADA mostravano anche un'incidenza di sanguinamento totale inferiore in modo statisticamente significativo. I soggetti randomizzati a Dabigatran Etexilato EG STADA 110 mg due volte al giorno erano esposti a un rischio significativamente minore di sanguinamenti maggiori rispetto ai soggetti trattati con warfarin (hazard ratio 0,81 [p= 0,0027]). I soggetti randomizzati a Dabigatran Etexilato EG STADA 150 mg due volte al giorno erano esposti a un rischio significativamente maggiore di sanguinamenti GI rispetto ai soggetti trattati con warfarin (hazard ratio 1,48 [p= 0,0005]). Questi effetti sono stati riscontrati principalmente in pazienti di età ≥ 75 anni. I benefici clinici di dabigatran riguardo alla prevenzione dell'ictus e dell'embolia sistemica e alla riduzione del rischio di ICH rispetto a warfarin si mantengono nei vari sottogruppi individuali, ad es. compromissione renale, età, uso concomitante di medicinali quali medicinali antiaggreganti o inibitori della P-gp. Mentre certi sottogruppi di pazienti sono esposti ad un aumentato rischio di sanguinamento maggiore quando trattati con un anticoagulante, il rischio di sanguinamento in eccesso per dabigatran è dovuto al sanguinamento GI, tipicamente riscontrato entro i primi 3-6 mesi successivi all'inizio della terapia con Dabigatran Etexilato EG STADA.
|
|
Dabigatran Etexilato EG STADA 150 mg
due volte al giorno
|
Warfarin
|
Hazard ratio verso warfarin (intervallo di confidenza 95%)
|
|
Pazienti inclusi nell'analisi di sicurezza
|
2.456
|
2.462
|
|
|
Eventi di sanguinamento maggiore
|
24 (1,0%)
|
40 (1,6%)
|
0,60 (0.36- 0,99)
|
|
Sanguinamento intracranico
|
2 (0,1%)
|
4 (0,2%)
|
0.50 (0,09-2,74)
|
|
Sanguinamento GI maggiore
|
10 (0,4%)
|
12 (0,5%)
|
0,83 (0,36-1,93)
|
|
Sanguinamento pericoloso per la vita
|
4 (0,2%)
|
6 (0,2%)
|
0,66 (0,19- 2,36)
|
|
Eventi di sanguinamento maggiore / sanguinamenti
clinicamente rilevanti
|
109 (4,4%)
|
189 (7,7%)
|
0,56 (0,45-0,71)
|
|
Qualsiasi sanguinamento
|
354 (14,4%)
|
503 (20,4%)
|
0,67 (0,59-0,77)
|
|
Qualsiasi sanguinamento GI
|
70 (2,9%)
|
55 (2,2%)
|
1.27 (0,90-1,82)
|
|
|
Dabigatran Etexilato EG STADA 150 mg
due volte al giorno
|
Warfarin
|
Hazard ratio verso warfarin (Intervallo di confidenza 95%)
|
|
Pazienti trattati
|
1.430
|
1.426
|
|
|
Eventi di sanguinamento maggiore
|
13 (0,9%)
|
25 (1,8%)
|
0,54 (0,25 - 1,16)
|
|
Sanguinamento intracranico
|
2 (0,1%)
|
4 (0,3%)
|
Non calcolabile*
|
|
Sanguinamento GI maggiore
|
4 (0,3%)
|
8 (0,5%)
|
Non calcolabile*
|
|
Sanguinamento pericoloso per la vita
|
1 (0,1%)
|
3 (0,2%))
|
Non calcolabile*
|
|
Eventi di sanguinamento maggiore / sanguinamenti clinicamente rilevanti
|
80 (5,6%)
|
145 (10,2%)
|
0,55 (0,41 - 0,72)
|
|
Qualsiasi sanguinamento
|
278 (19,4%)
|
373 (26,2%)
|
0,71 (0,61 - 0,83)
|
|
Qualsiasi sanguinamento GI
|
45 (3,1%)
|
32 (2,2%)
|
1,39 (0,87 - 2,20)
|
|
|
Dabigatran Etexilato EG STADA 150 mg due volte al giorno
|
Placebo
|
Hazard ratio verso placebo (intervallo di confidenza 95%)
|
|
Pazienti trattati
|
684
|
659
|
|
|
Eventi di sanguinamento maggiore
|
2 (0,3%)
|
0
|
Non calcolabile
|
|
Sanguinamento intracranico
|
0
|
0
|
Non calcolabile
|
|
Sanguinamento GI maggiore
|
2 (0,3%)
|
0
|
Non calcolabile
|
|
Sanguinamento pericoloso per la vita
|
0
|
0
|
Non calcolabile
|
|
Eventi di sanguinamento maggiore / sanguinamenti clinicamente rilevanti
|
36 (5,3%)
|
13 (2,0%)
|
2.69 (1,43 - 5,07)
|
|
Qualsiasi sanguinamento
|
72 (10,5%)
|
40 (6,1%)
|
1.77 (1,20 - 2,61)
|
|
Qualsiasi sanguinamento GI
|
5 (0,7%)
|
2 (0,3%)
|
2.38 (0,46 - 12,27)
|
Tabella 18: Reazioni avverse
|
SOC / Termine preferito
|
Frequenza
|
|
Patologie del sistema emolinfopoietico
|
|
|
Anemia
|
Comune
|
|
Calo dell'emoglobina
|
Non comune
|
|
Trombocitopenia
|
Comune
|
|
Calo dell'ematocrito
|
Non comune
|
|
Neutropenia
|
Non comune
|
|
Agranulocitosi
|
Non nota
|
|
Disturbi del sistema immunitario
|
|
|
Ipersensibilità al medicinale
|
Non comune
|
|
Rash cutaneo
|
Comune
|
|
Prurito
|
Non comune
|
|
Reazione anafilattica
|
Non nota
|
|
Angioedema
|
Non nota
|
|
Orticaria
|
Comune
|
|
Broncospasmo
|
Non nota
|
|
Patologie del sistema nervoso
|
|
|
Emorragia intracranica
|
Non comune
|
|
Patologie vascolari
|
|
|
Ematoma
|
Comune
|
|
Emorragia
|
Non nota
|
|
Patologie respiratorie, toraciche e mediastiniche
|
|
|
Epistassi
|
Comune
|
|
Emottisi
|
Non comune
|
|
Patologie gastrointestinali
|
|
|
Emorragia gastrointestinale
|
Non comune
|
|
Dolore addominale
|
Non comune
|
|
Diarrea
|
Comune
|
|
Dispepsia
|
Comune
|
|
Nausea
|
Comune
|
|
Emorragia rettale
|
Non comune
|
|
Emorragia emorroidale
|
Non nota
|
|
Ulcera gastrointestinale, inclusa ulcera
esofagea
|
Non nota
|
|
Gastroesofagite
|
Non comune
|
|
Malattia da reflusso gastroesofageo
|
Comune
|
|
Vomito
|
Comune
|
|
Disfagia
|
Non comune
|
|
Patologie epatobiliari
|
|
|
Funzionalità epatica alterata / Test di
funzionalità epatica alterati
|
Non nota
|
|
Aumento dell'alanina aminotransferasi
|
Non comune
|
|
Aumento dell'aspartato aminotransferasi
|
Non comune
|
|
Aumento degli enzimi epatici
|
Comune
|
|
Iperbilirubinemia
|
Non comune
|
|
Patologie della cute e del tessuto sottocutaneo
|
|
|
Emorragia cutanea
|
Non comune
|
|
Alopecia
|
Comune
|
|
Patologie del sistema muscoloscheletrico e del tessuto connettivo
|
|
|
Emartrosi
|
Non nota
|
|
Patologie renali e urinarie
|
|
|
Emorragia genitourinaria, inclusa ematuria
|
Non comune
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione
|
|
|
Emorragia al sito di iniezione
|
Non nota
|
|
Emorragia al sito di inserzione del catetere
|
Non nota
|
|
Traumatismo, avvelenamento e complicazioni da procedura
|
|
|
Emorragia traumatica
|
Non comune
|
|
Emorragia al sito di incisione
|
Non nota
|
Sovradosaggio
Scadenza
Conservazione
Farmaci Equivalenti
Foglietto Illustrativo
Fonti Ufficiali
© 2022 EDRA S.p.A. - P.iva 08056040960
DPO - dpo@lswr.it