Belkyra
Ultimo aggiornamento: 08/11/2022
Cos'è Belkyra?
Belkyra è un farmaco a base del principio attivo
Acido Desossicolico, appartenente alla categoria degli
Dermatologici e nello specifico
Altri dermatologici. E' commercializzato in Italia dall'azienda
AbbVie S.r.l..
Belkyra può essere prescritto con Ricetta RRL - medicinali soggetti a prescrizione medica limitativa, vendibili al pubblico su prescrizione di centri ospedalieri o di specialisti.
Belkyra può essere prescritto con Ricetta RRL - medicinali soggetti a prescrizione medica limitativa, vendibili al pubblico su prescrizione di centri ospedalieri o di specialisti.
Confezioni
Belkyra 10 mg/ml soluzione iniettabile 4 flaconcini da 2 ml
Informazioni commerciali sulla prescrizione
Titolare: AbbVie S.r.l.
Ricetta: RRL - medicinali soggetti a prescrizione medica limitativa, vendibili al pubblico su prescrizione di centri ospedalieri o di specialisti
Classe: CN
Principio attivo: Acido Desossicolico
Gruppo terapeutico: Dermatologici
ATC: D11AX24 - Acido deossicolico
Forma farmaceutica: soluzione (uso interno)
Ricetta: RRL - medicinali soggetti a prescrizione medica limitativa, vendibili al pubblico su prescrizione di centri ospedalieri o di specialisti
Classe: CN
Principio attivo: Acido Desossicolico
Gruppo terapeutico: Dermatologici
ATC: D11AX24 - Acido deossicolico
Forma farmaceutica: soluzione (uso interno)
Se sei un professionista, potrai trovare le schede tecniche complete e molto altro nell'area riservata di Codifa.it
Indicazioni
Perché si usa Belkyra? A cosa serve?
- Belkyra è indicato per il trattamento della convessità o pienezza da moderata a grave associata a grasso submentale in soggetti adulti quando la presenza di grasso submentale abbia un impatto psicologico importante per il paziente.
Posologia
Come usare Belkyra: Posologia
Posologia
Il volume totale iniettato e il numero di sessioni di trattamento devono essere personalizzati in base alla distribuzione di grasso submentale del singolo paziente e agli obiettivi del trattamento.
Iniettare 0,2 ml (2 mg) per sito di iniezione, a 1 cm di distanza tra un sito e l'altro. In una singola sessione di trattamento non si deve superare la dose massima di 10 ml (100 mg equivalenti a 50 iniezioni).
Possono essere eseguite fino a un massimo di 6 sessioni di trattamento. La maggior parte dei pazienti manifesta un miglioramento dopo 2-4 sessioni di trattamento.
L'intervallo di tempo tra le sessioni di trattamento deve essere di almeno 4 settimane.
Per migliorare il comfort del paziente durante l'iniezione, a discrezione dell'operatore sanitario, è possibile somministrare analgesici o FANS orali, anestesia locale topica e/o iniettabile (per es. lidocaina) e/o raffreddare l'area dell'iniezione applicando confezioni di ghiaccio gel.
Popolazioni speciali
Compromissione renale
Non si ritiene necessario alcun aggiustamento della dose (vedere paragrafo 5.2).
Compromissione epatica
Non si ritiene necessario alcun aggiustamento della dose (vedere paragrafo 5.2).
Anziani (età pari e superiore a 65 anni)
Non si ritiene necessario alcun aggiustamento della dose. Occorre prestare cautela nei pazienti anziani (vedere paragrafo 4.4).
Popolazione pediatrica
L'uso di Belkyra nei bambini o negli adolescenti non è indicato.
Modo di somministrazione
Il prodotto è indicato esclusivamente per la somministrazione sottocutanea.
Belkyra deve essere somministrato esclusivamente da medici che possiedano le opportune qualifiche, la competenza nel trattamento e la conoscenza dell'anatomia del submento. Ove permesso a livello nazionale, Belkyra può essere somministrato da operatori sanitari qualificati, sotto la supervisione di un medico. L'uso sicuro ed efficace di Belkyra dipende da una scelta appropriata del paziente, che comprende la conoscenza della storia di precedenti interventi del paziente e della loro capacità di alterare l'anatomia della fascia cervicale superficiale. Considerare con attenzione l'uso di Belkyra nei pazienti con eccessiva lassità della pelle, bande del platisma prominenti o altre condizioni per le quali la riduzione del grasso submentale potrebbe produrre un risultato indesiderato.
Belkyra deve essere usato esclusivamente per una sessione di iniezione(i) per paziente e l'eccesso di prodotto non utilizzato deve essere smaltito in modo appropriato.
Belkyra è fornito in flaconcini monouso, pronti all'uso. Prima dell'uso capovolgere delicatamente il flaconcino più volte. Non diluire.
Per le iniezioni di Belkyra, inserire l'ago perpendicolarmente alla pelle.
Il posizionamento dell'ago rispetto alla mandibola è molto importante perché riduce la possibilità di lesioni al nervo marginale mandibolare, un ramo motorio del nervo facciale. La lesione del nervo si presenta come un sorriso asimmetrico dovuto alla paresi dei muscoli depressori delle labbra.
Per evitare lesioni al ramo marginale mandibolare del nervo facciale:
- Non iniettare al di sopra del margine inferiore della mandibola.
- Non iniettare nell'area definita da una linea di 1-1,5 cm sotto il margine inferiore (dall'angolo della mandibola verso il mento).
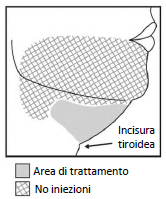
- Iniettare Belkyra solo nell'area individuata di grasso submentale (vedere Figure 1 e 3).
Figura 1. Evitare l'area del nervo marginale mandibolare
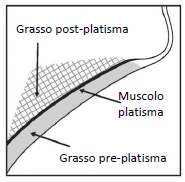
Evitare l'iniezione nel platisma. Prima di ogni sessione di trattamento, palpare l'area del submento per verificare la presenza di una quantità sufficiente di grasso submentale e per identificare il grasso sottocutaneo tra il derma e il platisma (grasso pre-platisma) nell'area di trattamento individuata (Figura 2).
Figura 2. Vista sagittale dell'area del platisma
Evidenziare l'area di trattamento pianificata con un pennarello chirurgico e applicare una griglia di iniezione di 1 cm2 per contrassegnare i siti di iniezione (Figure 2 e 3).
Figura 3. Area di trattamento e schema di iniezione
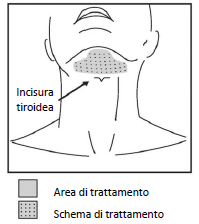
Non iniettare Belkyra al di fuori dei parametri definiti.
La soluzione iniettabile deve essere ispezionata visivamente prima dell'uso. Devono essere utilizzate solo le soluzioni limpide, incolori e prive di particelle visibili.
Controindicazioni
Quando non dev'essere usato Belkyra
- Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1
- Presenza di infezione nelle sedi di iniezione proposte
Avvertenze speciali e precauzioni di impiego
Cosa serve sapere prima di prendere Belkyra
Somministrare esclusivamente per via sottocutanea.
Iniezioni in aree vulnerabili o nelle loro vicinanze
Non iniettare il prodotto entro 1-1,5 cm di distanza da strutture anatomiche vulnerabili.
Belkyra non deve essere iniettato nel ramo marginale mandibolare del nervo facciale o nelle sue vicinanze, onde evitare la possibilità di neuroaprassia motoria, che si manifesta come un sorriso asimmetrico o debolezza dei muscoli facciali. Negli studi clinici, la lesione del nervo è stata temporanea e tutti i casi si sono risolti.
Occorre prestare attenzione per evitare l'accidentale iniezione intradermica o intramuscolare. Belkyra deve essere iniettato a profondità intermedia nel tessuto adiposo pre-platismatico sottocutaneo nell'area submentale. Tecniche di iniezione inadeguate quali iniezioni superficiali, iniezioni nei vasi sanguigni e iniezioni senza l'utilizzo della griglia di marcatura cutanea potrebbero causare ulcerazione e necrosi cutanea, nonché cicatrici (vedere paragrafo 4.8). Durante l'iniezione l'ago non deve essere estratto dal grasso sottocutaneo, in quanto questo potrebbe aumentare il rischio di esposizione intradermica e una possibile ulcerazione e necrosi cutanea. Qualora si verifichino ulcerazione o necrosi al sito di iniezione, Belkyra non deve essere ri-somministrato.
Deve essere prestata attenzione per evitare l'iniezione involontaria direttamente in un'arteria o in una vena poiché può provocare lesioni vascolari.
Evitare l'iniezione nelle ghiandole salivari, nella ghiandola tiroidea, nei linfonodi e nei muscoli.
L'uso sicuro ed efficace di Belkyra al di fuori dell'area di grasso submentale o a dosi superiori a quelle raccomandate non è stato stabilito. Belkyra non deve essere usato in pazienti obesi (IMC ≥ 30) o con disturbo di dismorfismo corporeo.
Condizioni/trattamenti preesistenti nell'area da trattare o nelle sue vicinanze
Prima dell'uso di Belkyra i pazienti devono essere sottoposti ad esami per individuare altre cause potenziali di convessità/pienezza del submento (per es. tiromegalia e linfoadenopatia cervicale).
Occorre usare cautela quando Belkyra viene somministrato in presenza di infiammazione o indurimento nella(e) sede(i) di iniezione proposte o in pazienti con sintomi di disfagia.
Occorre usare cautela quando Belkyra è somministrato in pazienti che hanno avuto precedenti interventi chirurgici o trattamenti estetici nell'area del submento. Cambiamenti nell'anatomia/nelle caratteristiche principali dell'area o la presenza di tessuto cicatriziale potrebbero influire sulla possibilità di somministrare Belkyra in sicurezza o di ottenere il risultato desiderato.
Anziani
Gli studi clinici su Belkyra non hanno incluso numeri sufficienti di pazienti di età pari o superiore a 65 anni per poter determinare se questi soggetti rispondono in modo diverso rispetto ai pazienti più giovani; pertanto, occorre usare cautela con questi pazienti.
Regime dietetico iposodico
Questo medicinale contiene 184 µmol (o 4,23 mg) di sodio per ml. Ciò deve essere tenuto in considerazione per i pazienti che seguono una dieta a basso contenuto di sodio.
Interazioni con altri medicinali e altre forme di interazione
Quali farmaci o alimenti possono modificare l'effetto di Belkyra
Non sono stati effettuati studi clinici di interazione con Belkyra.
Fertilità, gravidanza e allattamento
Gravidanza
Sono stati effettuati studi sulla riproduzione in ratti e conigli a esposizioni fino a 1,8 volte (ratti) e 12 volte (conigli) superiori alla dose massima raccomandata per l'uomo. Sebbene non siano emersi effetti dannosi diretti o indiretti per quanto riguarda la tossicità riproduttiva, nello studio di tossicità embrio-fetale nei conigli sono stati osservati risultati inconclusivi relativamente alla mancanza del lobo polmonare intermedio (vedere paragrafo 5.3).
Non ci sono studi adeguati e ben controllati nelle donne in gravidanza. Come misura precauzionale, è preferibile evitare l'uso di Belkyra durante la gravidanza.
Allattamento
Non sono disponibili informazioni sulla presenza di Acido Desossicolico nel latte umano, sugli effetti del farmaco sui neonati allattati al seno o sugli effetti del farmaco sulla produzione di latte. Poiché non sono stati effettuati studi in madri che allattano al seno, occorre prestare cautela quando si somministra Belkyra a una donna che allatta al seno.
Fertilità
Non ci sono dati clinici sulla fertilità.
Belkyra non ha influito sulla prestazione riproduttiva generale o sulla fertilità in ratti maschi e femmine a dosi fino a 50 mg/kg, corrispondenti rispettivamente a circa 5 volte e 3 volte i margini di esposizione alla dose massima raccomandata per l'uomo (vedere paragrafo 5.3).
Effetti sulla capacità di guidare veicoli e sull'uso di macchinari
Non sono stati effettuati studi sulla capacità di guidare veicoli e sull'uso di macchinari.
Effetti indesiderati
Quali sono gli effetti collaterali di Belkyra
I dati riportati nella tabella sottostante riflettono gli effetti indesiderati segnalati in pazienti trattati con Belkyra che sono stati valutati nel corso di studi clinici durante i quali è stato analizzato l'uso di Belkyra per il trattamento del grasso submentale o segnalati per i pazienti valutati nel periodo post-marketing.
Nel corso degli studi clinici sono stati segnalati i seguenti effetti indesiderati con queste frequenze:
- Molto comune (≥1/10)
- Comune (≥1/100, <1/10)
- Non comune (≥1/1.000, ≤1/100)
- Raro (≥1/10.000, ≤1/1.000)
- Molto raro (<1/10.000)
- Non nota (la frequenza non può essere definita sulla base dei dati disponibili).
|
Classificazione per sistemi e organi
|
Frequenza
|
Reazione avversa
|
|
Patologie del sistema nervoso
|
Comune
|
Cefalea
|
|
Non comune
|
Disgeusia
|
|
|
Non nota
|
Ipoestesia orale, parestesia orale
|
|
|
Patologie respiratorie, toraciche e mediastiniche
|
Non comune
|
Disfonia
|
|
Patologie gastrointestinali
|
Comune
|
Disfagia, nausea
|
|
Patologie della cute e del tessuto sottocutaneo
|
Comune
|
Tumefazione cutanea
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione
|
Molto comune
|
Sede di iniezione: dolore, edema, tumefazione, anestesia, nodulo, ematoma, parestesia, indurimento, eritema, prurito.
|
|
Comune
|
Sede di iniezione: emorragia, fastidio, calore, alterazione del colore.
|
|
|
Non comune
|
Sede di iniezione: alopecia, orticaria, ulcera, ipersensibilità, cicatrice**.
|
|
|
Non nota
|
Sede di iniezione: Ipoestesia, necrosi*, necrosi dell'arteria
|
|
|
Traumatismo, avvelenamento e complicazioni da procedura
|
Comune
|
Lesione del nervo in sede di iniezione
|
|
Non nota
|
Lesione vascolare dovuta a iniezione intravascolare involontaria
|
* Le reazioni avverse correlate alla necrosi al sito di iniezione sono state riportate come necrosi adiposa, necrosi, necrosi della cute e necrosi del tessuto molle. Questi eventi sono stati riscontrati intorno all'area di trattamento con un'area interessata compresa tra 0,5 cm e 3 cm. In rari casi, è stata interessata l'intera area submentale.
** Sono state riportate cicatrici al sito di iniezione in seguito a ulcerazione o necrosi cutanea (vedere paragrafo 4.4) e come tessuto cicatriziale post-iniezione.
In generale, la maggior parte delle reazioni avverse si è risolta entro l'intervallo di trattamento. La tabella seguente presenta le reazioni avverse che sono state riportate durare più a lungo dell'intervallo di 4 settimane tra le due iniezioni, nei pazienti trattati con Belkyra (N=758), in base ai risultati dei 4 studi di fase 3.
|
Reazioni avverse
|
BELKYRA
|
Tempo medio alla risoluzione a
(intervallo)
|
|
Lesione del nervo nel sito d'iniezione
|
3,6%
|
53 giorni (1-334 giorni)
|
|
Indurimento del sito d'iniezione
|
23,4%
|
41 giorni (1-292 giorni)
|
|
Nodulo nel sito d'iniezione
|
12,0%
|
48 giorni (1-322 giorni)
|
|
Dolore nel sito d'iniezione
|
74,1%
|
12 giorni (1-333 giorni)
|
|
Sintomi sensoriali nel sito
d'iniezione
|
66,4%
|
46 giorni (1-349 giorni)
|
|
Anestesia nel sito d'iniezione
|
61,6%
|
50 giorni (1-349 giorni)
|
|
Parestesia nel sito d'iniezione
|
11,3%
|
27 giorni (1-297 giorni)
|
|
Gonfiore nel sito d'iniezione
|
78,6%
|
15 giorni (1-218 giorni)
|
|
Disfagia
|
1,5%
|
22 giorni (1-142 giorni)
|
a: Solo in relazione al gruppo BELKYRA
Negli studi clinici, alcune delle reazioni locali, quali indurimento, nodulo, anestesia, dolore e gonfiore nel sito d'iniezione e lesione del nervo motorio nel sito d'iniezione sono state segnalate come non risolti entro la durata degli studi clinici.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all'indirizzo https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Sovradosaggio
Cosa fare se avete preso una dose eccessiva di Belkyra
Non è stato segnalato sovradosaggio di Belkyra nell'uomo.
L'iniezione di volumi maggiori o la riduzione della distanza tra le iniezioni di Belkyra potrebbe aumentare il rischio di effetti avversi locali. Le reazioni avverse nelle aree non trattate o le reazioni avverse sistemiche sono state infrequenti durante gli studi clinici a dosi fino a 200 mg.
Scadenza
30 mesi
Il prodotto deve essere usato immediatamente una volta che il tappo del flaconcino è stato perforato.
Se non viene usato immediatamente, i tempi e le condizioni di conservazione in uso sono responsabilità dell'utilizzatore.
Conservazione
Questo medicinale non richiede alcuna speciale condizione di conservazione.
Per le condizioni di conservazione del medicinale dopo la prima apertura, vedere paragrafo 6.3.
Foglietto Illustrativo
Fonti Ufficiali
© 2022 EDRA S.p.A. - P.iva 08056040960
DPO - dpo@lswr.it